本文由brainnews腦科學世界團隊原創編譯,轉載請聯絡授權。
神經活動的穩態失調被認為可能是促進阿爾茨海默病(AD)病變的機制。
眾所周知,在AD出現臨床表現(認知功能受損等)之前的10-20年,就已經出現了澱粉樣蛋白(Aβ)的沉積,在這段漫長的無症狀期,神經活動的穩態機制是否已經出現功能失調還尚未可知。
Inna Slutsky教授帶領的團隊針對該問題進行了一系列的研究,發現在出現認知障礙症狀前的清醒狀態下的AD模型鼠中,海馬神經環路沒有出現損傷,然而在非快速眼動睡眠期間(NREM)以及全麻狀態(神經元的活性降低)下,海馬的神經環路穩態出現了功能失調。
該教授團隊於2022年1月於Cell Reports雜誌發表了題為“Disrupted neural correlates of anesthesia and sleep reveal early circuit dysfunctions in Alzheimer models”的文章。
1. APP/PS1小鼠在清醒狀態下海馬CA1神經元活性正常
實驗所用小鼠為4-5月齡APP/PS1基因突變小鼠,該小鼠在出現明顯的澱粉樣蛋白沉積(Aβ40,Aβ42以及Aβ42與Aβ40的比值升高)的同時,其認知功能未出現明顯受損(空間記憶、條件依賴的恐懼記憶未受損,但在9月齡時會出現受損)。
實驗採用寬視野頭戴式的熒光微型顯微鏡在單神經元的水平上快速和長時間地追蹤Ca2+的動態變化來顯示神經元的活性(圖1A)。結果顯示,APP/PS1小鼠在清醒狀態下海馬CA1神經元細胞的Ca2+活動率與野生型(WT)小鼠無明顯差別(圖1B和C),在平均Ca2+活動率(mCaR)(圖1D),活性神經元數量(圖1E)以及神經元總的活性(圖1F)方面都無明顯差別。
同時,該實驗還採用長期植入的四級杆來直接記錄小鼠單個神經元的放電活動。結果同樣顯示,APP/PS1小鼠在清醒狀態下海馬CA1神經元細胞的平均放電率(MFR)與WT小鼠無明顯差別(圖1G-I)。
此外,在對細胞外的場興奮性突觸後電位的記錄觀察中發現APP/PS1小鼠在清醒狀態下海馬CA3-CA1的突觸傳遞和短期的突觸可塑性與WT小鼠無明顯差別(圖J-K)。
圖1.APP/PS1小鼠清醒狀態下CA1神經網路活性以及CA3-CA1突觸傳遞未出現受損
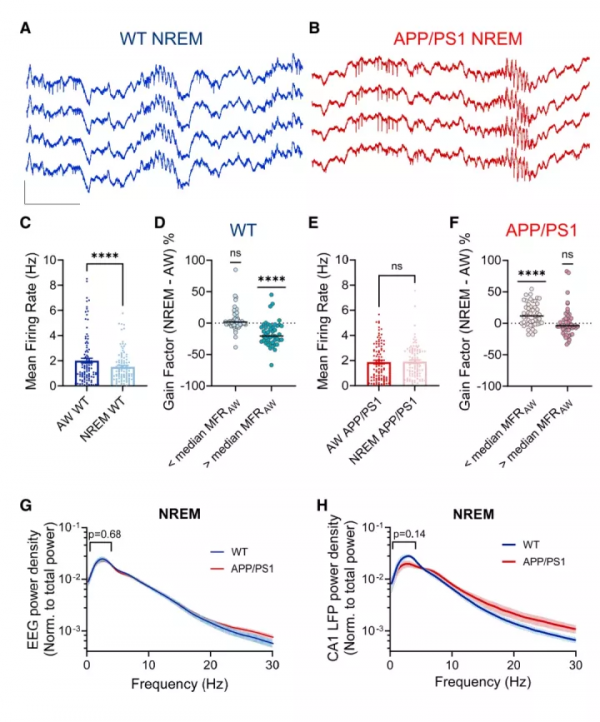
2. APP/PS1小鼠在非快速眼動睡眠 期間出現海馬CA1神經元MFR異常
正常情況下,在NREM期間,海馬CA1神經元的活性會下調(這被稱為區域性穩態機制)。可以看到,該實驗中WT小鼠的整體的海馬CA1神經元活性在NREM期間下降了大約60%(圖2A-D,I),然而在APP/PS1小鼠的NREM期間,海馬CA1神經元活性卻和清醒時無明顯改變(圖E-H,J)。
因此,可以得出在APP/PS1小鼠海馬CA1神經元在NREM期間的一個典型負性調控出現了明顯的功能失調(圖2K),說明CA1神經元MFR的穩態調控功能出現受損。
圖2. APP/PS1小鼠在非快速眼動睡眠(NREM)期間海馬CA1神經元負性調控功能出現異常
3. APP/PS1小鼠NREM期間海馬CA1神經元區域性放電率異常要早於整體慢波震盪異常
WT小鼠在NREM期間,MFR會比在清醒狀態下降低(圖3A,C),其中低於清醒狀態下神經元MFR中位值(1.4HZ)的那部分細胞在NREM期間的活性未出現明顯改變,而高於中位值的那部分細胞則出現明顯的活性降低(圖3D)。
然而在APP/PS1小鼠中發現,不管是清醒狀態還是NREM狀態下,MFR沒有出現明顯改變(圖3B,E),可能是因為其中低於清醒狀態下神經元MFR中位值的那部分細胞在NREM期間的活性出現升高,而原來高於中位值的那部分細胞的活性則沒有發生改變(圖3F)。
考慮到之前在AD患者和AD小鼠模型中出現整體慢波震盪異常,為了探究上述神經元活性的改變是否是來自慢波震盪異常,該實驗檢測了小鼠的腦電圖,發現APP/PS1小鼠和WT小鼠的慢波腦電圖(圖3G)以及區域性場電位(LFP)的慢波(圖3H)並未有明顯的不同。這說明APP/PS1小鼠NREM期間海馬CA1神經元區域性放電率異常要早於整體慢波震盪異常。
圖3.APP/PS1小鼠NREM期間海馬CA1神經元區域性放電率異常要早於整體慢波震盪異常
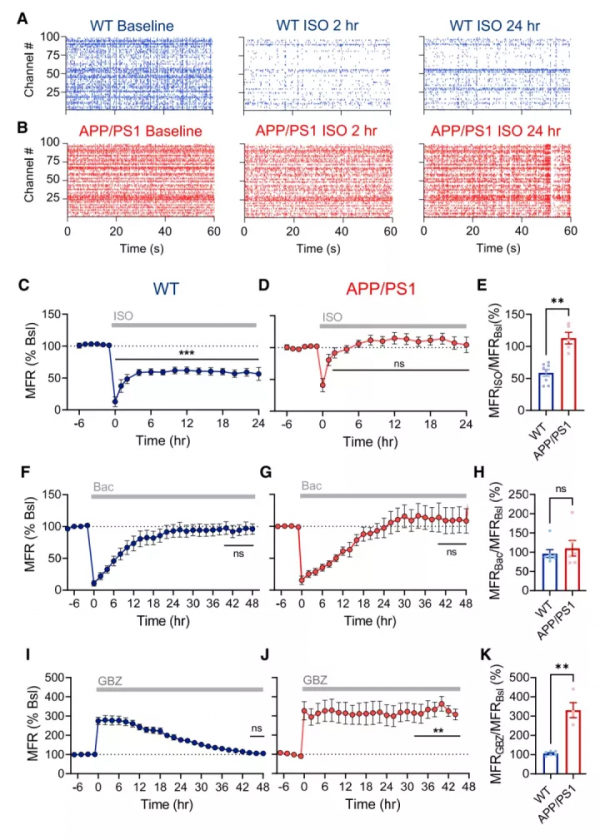
4. APP/PS1小鼠失去在全麻狀態下的神經元抑制功能
該實驗使用異氟醚(ISO)來誘導產生麻醉。研究發現,在異氟醚作用下,WT小鼠會出現明顯的CA1神經元細胞群的抑制(圖4A,C),主要是因為活性神經元細胞數量的減少(圖4C)。
然而APP/PS1小鼠的CA1神經元細胞群沒有出現明顯的抑制(圖4B,D),最終導致麻醉狀態下整體神經元活性和清醒時無明顯區別(圖E)。
此外,與WT小鼠相比,APP/PS1小鼠出現明顯的超同步化現象,其放電細胞的數量(圖4F)以及神經網路中的放電量(圖4G)大大增加。在實驗人員使用其他麻醉藥物之後,上訴結果仍然出現,說明APP/PS1小鼠失去本應在在全麻狀態下出現的神經元抑制功能。
圖4. APP/PS1小鼠失去在全麻狀態下的神經元抑制功能
5. 不同的fAD小鼠模型在麻醉狀態下都出現過度興奮性的現象
該實驗使用不同的轉基因AD小鼠來進一步確認上述發現,即在麻醉狀態下,APP/PS1小鼠的神經元抑制功能失調。研究發現,不僅在APP/PS1小鼠,在5xFAD小鼠以及APP-KI小鼠中,上述現象仍然存在(圖5A-C)。證明這種現象是在AD模型小鼠中普遍存在的,而不是僅僅是單一模型AD小鼠中的特有現象。
圖5. 不同的fAD小鼠模型在麻醉狀態下都出現過度興奮性的現象
6. fAD突變導致下調MFR穩態失衡
該實驗使用體外海馬神經元多電極陣列(MEAs)檢測MFR穩態機制。研究發現,異氟醚的使用會導致WT的MFR水平下調,在一個新的下降的調定點(set-point)波動(圖6A,C)。然而同樣在異氟醚的試用下,APP/PS1突變導致雖然出現MFR下降,但是馬上升高到一個更高MFR水平,相當於調定點的升高(圖6B,D)。
這就說明與WT相比,APP/PS1突變導致海馬神經元出現明顯的過度興奮性(圖6E),但是它並沒有損傷MFR的基本穩態調節反應(圖F-H)。
正常情況下,使用γ-氨基丁酸(GABA)受體拮抗劑之後,MFR的水平會出現明顯升高,但其調節機制會使MFR的水平之後緩慢降低,WT海馬神經元的表現就是如此(圖6I)。
然而,APP/PS1突變導致該過程的穩態調節出現異常,在APP/PS1突變的海馬神經元中,MFR無法降低到原來的水平,而是持續地維持在高水平狀態(圖6J-K)。
圖6. 體外海馬神經元實驗發現fAD突變導致下調MFR穩態失衡
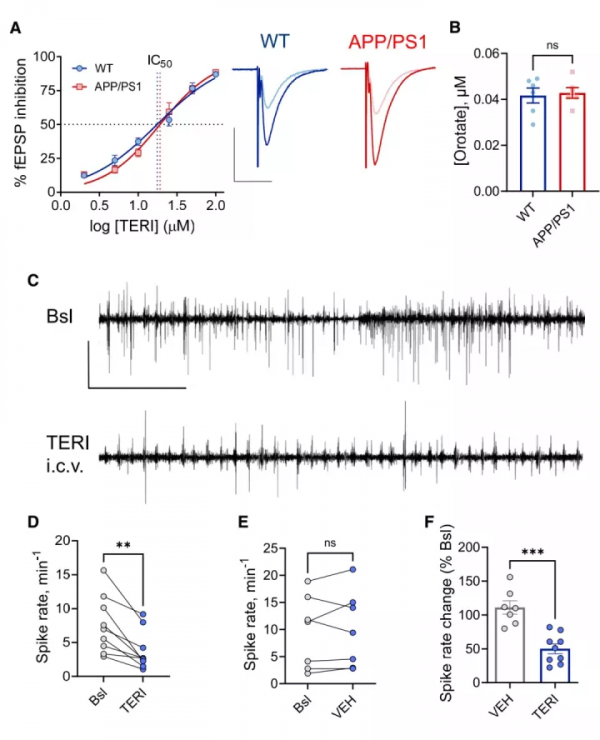
7. 抑制線粒體線粒體二氫乳清酸脫氫酶可以降低麻醉狀態下CA1神經元的興奮過度
線粒體DHODH酶可以調節MFR的調定點。特利氟米特(TERI)是DHODH酶抑制劑,該實驗將TERI經載體(VEH)注入小鼠腦室內進行實驗。研究發現,麻醉狀態下APP/PS1小鼠CA1神經元中的癲癇樣的異常高壓電波可以被TREI抑制(圖7C),而且放電率有所降低(圖7D-F)。
圖7. 特利氟米特(TERI)可以降低麻醉狀態下的APP/PS1小鼠CA1神經元的過度興奮
結 論
在AD早期無症狀階段,CA1神經網路在低興奮性狀態的麻醉或者非快速眼動睡眠期間已經出現異常,然在清醒狀態則無明顯改變。這個過度興奮性可以被調節MFR的DHODH酶抑制劑緩解。
參考文獻
Zarhin et al., 2022, Cell Reports 38, 110268 January 18, 2022. https://doi.org/10.1016/j.celrep.2021.110268.
編譯作者:KK(brainnews創作團隊)
校審:Simon(brainnews編輯部)