編者按:2022年1月21日,由亞太肝臟研究協會(APASL)聯合歐洲肝臟研究協會(EASL)旗下官方期刊Journal of Hepatology共同舉辦的網路討論會如期而至,會議討論的主題為JOH雜誌2021年所刊登文章中的佼佼者。席間,西班牙Maria Buti教授分享了病毒性肝炎領域的年度佳作。那麼,慢性乙型肝炎(CHB)領域中究竟有哪些研究光榮上榜呢?讓我們一同來揭曉答案吧!
HBeAg陰性CHB病毒感染與cccDNA轉錄活性降低有關
在CHB病毒感染的自然過程中,免疫反應可以控制病毒複製。藉助對CHB不同階段患者肝活檢組織中病毒DNA和RNA的定量分析,我們得以確定病毒週期中那些使疾病從活動過渡到非活動的關鍵步驟。針對這些步驟的靶向治療藥物也許能誘導病毒轉錄的持續抑制。其中,尤其令人感興趣的是HBeAg陰性慢性感染(ENCI)的轉變。ENCI以前被稱為非活動狀態狀態,其特徵是低病毒血症或HBV DNA檢測不到,且沒有肝臟疾病。然而,我們對於機體如何向ENCI過渡以及控制ENCI中病毒複製的分子機制知之甚少。
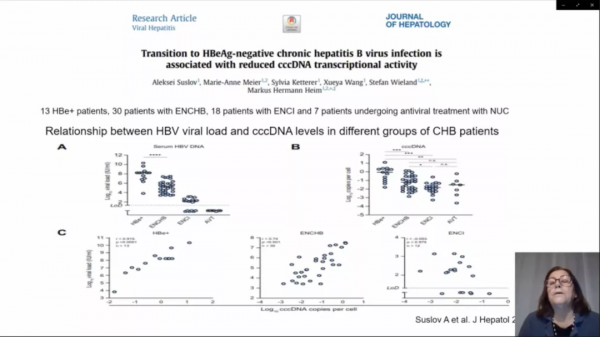
為了確定在向ENCI過渡期間HBV生命週期中的哪些步驟受到控制,瑞士巴塞爾大學醫院Suslov A等透過一項研究[1],對68例CHB不同階段患者的活檢標本中的cccDNA、前基因組RNA(pgRNA)、總HBV RNA和DNA複製中間產物進行了定量分析。
結果顯示:HBeAg血清學轉換與cccDNA複製數量和轉錄活性的降低有關。cccDNA的沉默在ENCI中尤其明顯,與HBeAg陰性CHB相比,ENCI中每個cccDNA的pgRNA減少僅為前者的1/46。此外,HBeAg陰性CHB患者亞組的特徵是pgRNA下游的複製效率降低。
該項研究結果表明,在向ENCI過渡的過程中,血清病毒載量的降低似乎主要是由於cccDNA轉錄活性的強烈抑制所致,而cccDNA轉錄活性在沒有肝病的情況下可以維持。
HBsAg成分可預測HBeAg陽性CHB患者治療期間HBsAg的清除
在慢性HBV感染的治療過程中,HBsAg的清除或血清學轉換被認為是一種功能性治癒。HBsAg由大(LHB)、中(MHB)和小表面蛋白(SHB)組成,而它們的相對比例和CHB分期密切相關。德國萊比錫萊比錫大學醫學中心Pfefferkorn M等的這項研究旨在評估治療期間HBsAg成分與功能性治癒之間的關係[2]。
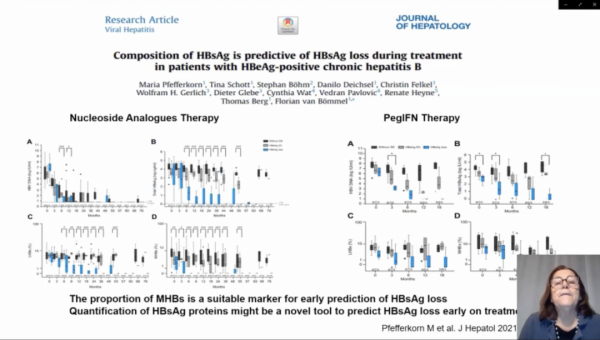
研究共納入83例CHB患者進行回顧性分析。在核苷(酸)類似物(NA)治療期間,有17/64名患者出現HBsAg清除,在聚乙二醇化干擾素-α 2a(PEG-IFN)治療48周後,有3/19名患者出現HBsAg清除。63名無HBsAg清除的患者作為對照。定量檢測治療前和治療期間收集的血清中的LHB、MHB和SHB。
分析表明,治療前獲得HBsAg清除的患者的平均MHB水平顯著低於無HBsAg清除的患者(P=0.005)。在治療過程中,HBsAg清除患者的MHBs和LHBs比例迅速下降,HBeAg血清學轉換的患者和無血清學應答患者的MHBs和LHBs比例沒有下降。在所有HBsAg清除的患者中,在NA治療第6個月時,MHB檢測不到。受試者操作特徵曲線分析顯示,MHB比例是NA治療前HBsAg清除的最佳早期預測指標(AUC=0.726,P=0.019)。在使用PEG-IFN實現HBsAg清除的患者中,MHB和LHB的比例表現出相似的動力學。
綜上所述,該項研究發現,在HBsAg清除之前,LHBs和MHBs較HBsAg更早出現下降,研究者建議LHBs和MHBs可作為預測CHB功能性治癒的生物學標誌物。
HBeAg陰性CHB患者成功停藥的病毒學和免疫學因素
HBeAg陰性CHB患者成功實現NA停藥的相關因素尚不清楚。巴塞羅那大學臨床醫院García-López M等的這項研究[3]旨在分析成功停藥的患者的HBV特異性T細胞反應,以及外周和肝內病毒引數。結果顯示,HBeAg陰性CHB患者停藥後cccDNA轉錄減少和HBsAg水平降低與HBsAg清除有關。基線時存在功能性HBV特異性T細胞與停藥後的成功結局相關。
研究共前瞻性納入27例HBeAg陰性、CHB病毒完全抑制(>3年)、無肝硬化的患者。在基線檢查時對肝內HBV DNA(iHBV DNA)、肝內HBV RNA(iHBV RNA)和共價閉合環狀DNA(cccDNA)進行定量檢測。此外,在基線檢查和整個隨訪期間縱向分析血清學標誌物(HBV DNA、HBsAg、HBcrAg和HBV RNA)和HBV特異性T細胞反應。
在平均隨訪34個月後,27名患者中有22名(82%)仍處於停藥狀態,其中8名患者(佔總佇列的30%)HBsAg獲得清除。分析顯示,基線HBsAg與iHBV DNA和iHBV RNA顯著相關,並且這些引數在失去HBsAg的患者中較低。無論臨床結果如何,所有患者檢測到的cccDNA水平相似。獲得功能性治癒的患者基線HBsAg水平≤1000 IU/ml。除此之外,基線時功能性HBV特異性CD8+T細胞頻率的增加與持續的病毒控制治療相關。這些HBV特異性T細胞反應在停藥後持續存在,但沒有增加。
該項研究表明,在無肝硬化的CHB患者中可以成功實現NA停藥。患者停藥後,HBV特異性免疫T細胞反應的強度可能有助於成功控制病毒。該項研究提供了關於病毒學和免疫學因素的深入資料,有助於指導CHB患者的個體化治療。
一種新型長效抗HBV逆轉錄酶抑制劑
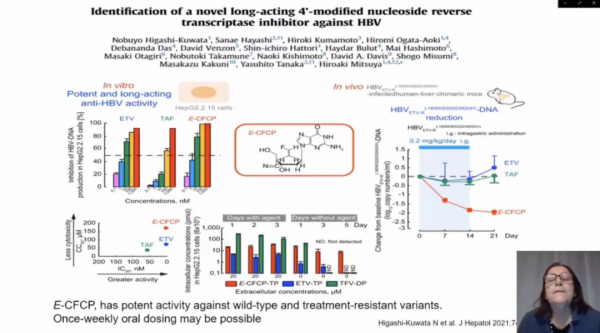
儘管某些核苷逆轉錄酶抑制劑(NRTI)在治療HBV感染方面有效,但其效果尚待最佳化。此外,由於CHB需要終身治療,耐NRTI突變病毒的出現是一個問題。為此,日本東京全球健康與醫學研究所的研究人員研發出了一種新型長效、4’-修飾NRTI,稱為E-CFCP[4]。研究人員先後在體外試驗和小鼠模型中檢測其抗HBV活性、長效特性及其與HBV逆轉錄酶(HBV-RT)的相互作用。
結果顯示:E-CFCP可顯著抑制細胞內HBV DNA的產生,使其低於檢測限,但恩替卡韋(ETV)和丙酚替諾福韋(TAF)未能達到這一點。同時,E-CFCP的毒性也低於ETV和TAF。分析顯示,E-CFCP更好地穿透肝細胞,並且更好地三磷酸化;E-CFCP-三磷酸鹽在細胞內的持續時間較ETV-三磷酸鹽長。在PXB小鼠中,每天一次口服E-CFCP超過2周(0.02~0.2 mg/kg/d)可使HBV病毒血症降低2-3 log,無明顯毒性,且在治療停止後1-3周內持續降低,表明每週一次的給藥能力。
該項研究結果表明,E-CFCP作為首個報道的長效NRTI,具有抗野生型和治療耐藥HBV的有效活性。此外,每週一次口服給藥是可能的,這與目前的每日給藥方案相比更加便捷高效。
新型、高敏HBcrAg檢測在管理CHB及HBV再啟用中的有效性
iTACT-HBcrAg是一種新型、全自動、高靈敏度的HBcrAg檢測方法。日本名古屋大學醫院等一項研究[5]將iTACT HBcrAg與其他HBV標誌物進行比較,旨在評估iTACT HBcrAg在監測CHB和早期檢測HBV再啟用方面的臨床應用。
研究透過iTACT HBcrAg和常規HBcrAg分析(G-HBcrAg),對161例HBeAg陰性CHB患者和持續檢測不到HBV DNA的連續血清進行測量,並透過iTACT HBcrAg和超高靈敏度HBsAg免疫複合物轉移化學發光酶免疫分析法(檢測下限;0.0005 IU/ml,ICT-CLEIA)測量13名HBV再啟用患者的血清,以比較HBV DNA檢測結果。
結果表明,iTACT HBcrAg的分析效能令人滿意。iTACT-HBcrAg的靈敏度約為G-HBcrAg的10倍。iTACT HBcrAg在97.5%(157/161)的CHB患者血清中檢測到HBcrAg,其中75.2%(121/161)的患者有HBcrAg≥2.8 log U/ml,22.4%(36/161)的HBcrAg為2.1-2.8 log U/ml,而該部分患者應用G-HBcrAg無法檢測到。
在13例HBV再啟用患者中,透過iTACT HBcrA發現分別有9例和2例在HBV DNA陽性之前和之後HBcrAg為陽性;在ICT-CLEIA檢測HBsAg陽性之前和之後,分別有7例和4例HBrAg陽性。
該項研究成果提示,iTACT HBcrAg可以更好地監測HBeAg陰性患者對抗HBV治療的反應,並用於早期檢測HBV再啟用。iTACT HBcrAg將有希望作為評估CHB疾病進展和治療應答的一般標誌物。
參考文獻:
[1] Suslov A, Meier MA, Ketterer S, et al. Transition to HBeAg-negative chronic hepatitis B virus infection is associated with reduced cccDNA transcriptional activity. J Hepatol. 2021 Apr;74(4):794-800.
[2] Pfefferkorn M, Schott T, Böhm S, et al. Composition of HBsAg is predictive of HBsAg loss during treatment in patients with HBeAg-positive chronic hepatitis B. J Hepatol. 2021 Feb;74(2):283-292.
[3] García-López M, Lens S, Pallett LJ, et al. Viral and immune factors associated with successful treatment withdrawal in HBeAg-negative chronic hepatitis B patients. J Hepatol. 2021 May;74(5):1064-1074.
[4] Higashi-Kuwata N, Hayashi S, Kumamoto H, et al. Identification of a novel long-acting 4'-modified nucleoside reverse transcriptase inhibitor against HBV. J Hepatol. 2021 May;74(5):1075-1086.
[5] Inoue T, Kusumoto S, Iio E, et al. Clinical efficacy of a novel, high-sensitivity HBcrAg assay in the management of chronic hepatitis B and HBV reactivation. J Hepatol. 2021 Aug;75(2):302-310.