本文來自微信公眾號:X-MOLNews
副標題:光誘導Cu(II)羧酸鹽的LMCT過程,實現羧酸的脫羧交叉偶聯
羧酸及其衍生物具有廉價易得、種類豐富、性質穩定等優點,因此,以之為原料的脫羧偶聯反應已成為構建具有複雜結構和多樣活性分子的有力工具。目前,最常見的現代脫羧偶聯策略本質上是氧化還原中性的,即羧酸親核體與親電體的交叉偶聯(圖1a),並廣泛應用於親電體有機鹵化物的C-C鍵構建中。相比之下,極性 C-N 和 C-O 鍵的構建通常需要使用內部氧化劑(如:羥基鄰苯二甲醯亞胺(PINO)、碘烷酯)對羧酸進行預官能團化(圖1b),導致反應步驟繁瑣、產物純化複雜。另一方面,Net-氧化脫羧交叉偶聯不僅避免了預官能團化的需要,而且為安裝簡單的氮和氧親核試劑提供了直接策略,其中最經典的方法是電解脫羧Kolbe反應,但是該過程需要溶劑量的雜核試劑作為犧牲氧化劑並且存在競爭的Kolbe二聚化。此外,不少課題組也報道過電催化脫羧醚的合成、電催化Ritter反應以及高溫促進的過渡金屬介導的氧化脫羧偶聯,但是上述策略仍存在官能團耐受性差、預官能團化、化學選擇性差、化學劑量的氧化劑等問題,從而嚴重阻礙了脫羧交叉偶聯反應的發展。
圖1. 脫羧偶聯反應的常見策略。圖片來源:Nat. Chem.
2020年,Larionov課題組報道了一種金屬光氧化還原策略,成功地實現了多種羧酸與芳胺的脫羧偶聯(Angew. Chem. Int. Ed., 2020, 59, 7921–7927)。在此基礎上,美國威斯康星大學麥迪遜分校的Tehshik P. Yoon教授課題組設想能否利用Cu(II)鹽內在的光化學性質,透過光誘導的配體-金屬電荷轉移(LMCT)過程來實現脫羧偶聯反應?近日,他們在可見光照射下,實現了銅介導的羧酸與多種親核試劑的氧化脫羧偶聯反應(圖1c)。初步機理研究表明該反應中的生色團是原位組裝的Cu(II)羧酸鹽物種,並且可見光誘導配體-金屬電荷轉移(LMCT)過程會導致自由基脫羧,從而引發氧化交叉偶聯。相關成果發表在Nature Chemistry 上。
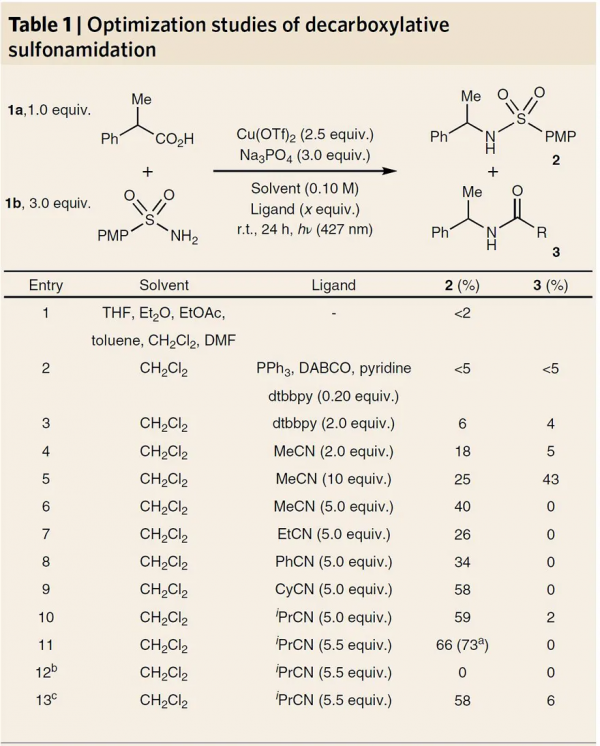
圖2. 反應條件的篩選。圖片來源:Nat. Chem.
鑑於磺醯胺類化合物在藥物化學中具有重要的藥物活性,作者選擇1-苯基丙酸 (1a) 與 4-甲氧基苯磺醯胺 (1b) 為模型底物對脫羧偶聯的反應條件進行了篩選(圖2)。首先,在鹼、Cu(OTf)2存在下用427 nm的LED燈照射時,在幾種常見的有機溶劑中僅觀查到痕量的產物(Entry 1);在Cu介導的轉化中常見的單齒和雙齒配體並不能促進反應的發生(Entry 2, 3),而乙腈作為配體則可以提高反應產率(Entry 4)。需要指出的是,該反應對乙腈極為敏感,5.0 equiv時反應效果最優,而用量較高則會生成Ritter加合物3。對腈配體結構的進一步研究表明,腈類配體i-PrCN(5.5 equiv)的反應效果最佳(Entry 7-11),能以 73% 的分離產率獲得產物2。此外,對照實驗表明該反應必須有光照條件(Entry 12)。最後,作者在大氣環境下用未純化的溶劑進行反應時,以58%的收率獲得產物2(Entry 13),體現了該偶聯反應的簡單可操作性。
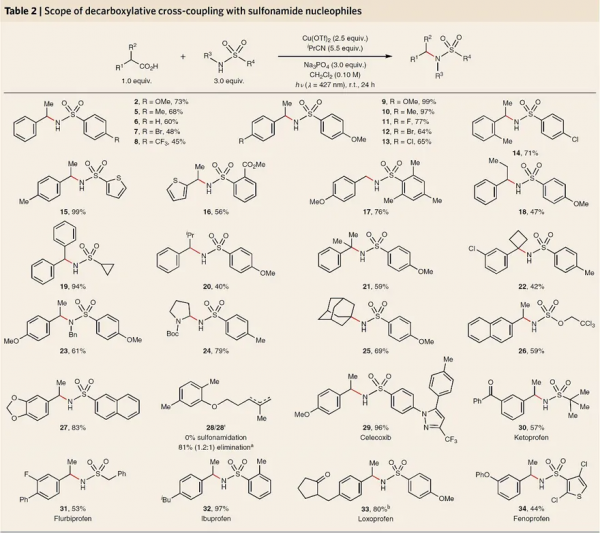
圖3. 反應條件篩選。圖片來源:Nat. Chem.
在最優條件下,作者對脫羧偶聯反應的底物相容性進行了考察(圖3)。對於芳基乙酸底物而言,給電子基團取代的芳烴效果最優(9-13),特別是鄰位甲基(14)、α-支鏈(18-22)取代的底物甚至α-氨基酸(24)均能相容該反應,以中等至較好的產率得到所需產物。遺憾的是,不飽和脂肪族羧酸並不能參與該反應(28),其優先經歷氧化消除而非親核取代反應,但立體受限的金剛烷羧酸卻能順利進行反應(25,收率:69%)。另一方面,偶聯試劑磺醯胺的底物範圍也較廣,無論是缺/供電子磺醯胺底物(2、5-8)還是雜芳基(15、34)和烷基(19、30、31)取代的伯磺醯胺甚至仲磺醯胺(23)均能實現這一轉化,以良好的收率得到交叉偶聯產物。此外,該反應還能耐受多種官能團,例如:芳基鹵化物(7、11-14、34)、酯基(16)、氨基甲酸酯(24)、氨基磺酸酯(26)、縮醛(27)、多環芳烴(26、27)等。最後,作者發現該反應對新候選藥物(29-34)的後期修飾也具有良好的反應性和官能團耐受性,進一步凸顯了該反應的強大之處。
在羧酸與磺醯胺的脫羧交叉偶聯反應成功實現後,作者對不同種類親核試劑的反應性進行了探究(圖4)。具體而言,將親核試劑的比例降至1.5當量並在 MeCN中進行反應,便可使一系列氨基甲酸酯(35-38)和醯胺(39)親核試劑順利偶聯。此外,無需外加親核試劑,在腈溶劑中進行脫羧反應便可實現Ritter醯胺化反應(40-46),從而為芳基乙酸的 Curtius 重排提供了一種有吸引力的替代方案。此外,醇作為親核試劑並不易偶聯。為此,作者對反應條件進一步最佳化,以甲苯為溶劑、MeCN為配體、吡啶為鹼性新增劑便可顯著提高反應效能,從而順利獲得脫羧醚化產物(47-71),同時還具有良好的官能團耐受性,例如:末端烯烴(64、66)、雜環(63、69、70)、受保護的糖(70)、磺醯胺(69)、滷代烷(67)和炔烴(68)。最值得注意的是,該策略不僅侷限於碳-雜鍵的構建,而且對碳-碳鍵的形成同樣適用,例如,雜芳烴(72-74)和富電子芳烴(75)均能以良好的收率獲得脫羧Friedel-Crafts烷基化產物。
圖4. 不同親核試劑的交叉偶聯反應底物拓展。圖片來源:Nat. Chem.
最後,作者對反應機理進行了推測。如圖5a所示,羧酸和Cu(OTf)2 在鹼介導下原位組裝成光活性生色團Cu(II)羧酸鹽,後者在光激發下發生LMCT過程生成易於脫酸的羧基自由基,隨後羧基自由基脫羧產生烷基自由基。接著,烷基自由基被Cu(II)氧化為碳正離子,併發生親核取代獲得最終的產物。為了進一步證實假設的反應機理,作者設計瞭如下實驗:1)伯羧酸32a在 Ritter 醯胺化條件下獲得脫羧自由基中間體的 5-exo-trig 環化產物76(圖4b);而環丙基取代的乙酸 33a 在氧化醚化條件下則獲得少量苄醚產物77(圖5c)。這些結果為碳中心自由基中間體的參與提供了關鍵證據;2)紫外-可見滴定實驗表明對應低能量吸收特徵的單體物種負責脫羧偶聯反應,這與經驗最佳化的反應條件非常吻合(圖5d)。低濃度1a-的加入會觀察到λmax = 304 nm的吸收帶變長,這與文獻中報道的其他單體 Cu (II) 羧酸鹽配合物的 LMCT 帶相當。若1a-的濃度大於1當量時,Cu(II)導致上述特徵消失並出現λmax= 260 nm的更高能帶的增長,此處與槳輪Cu(II)羧酸鹽二聚體的 LMCT 吸收帶相當;3)隨著1a濃度的增加,反應產率迅速下降,未反應的1a佔大部分,並導致二聚體藍移。若用254 nm光源照射(接近高能特徵的 λmax)1a和1b時,僅形成痕量的2和苄基自由基二聚化產物78(圖5e),而427 nm光源並不反應。基於以上結果,儘管多種Cu(II)羧酸鹽物種均可產生自由基,但氧化和隨後的親核偶聯僅發生在較低能量的可見光活化的配合物中。
圖5. 反應機理研究。圖片來源:Nat. Chem.
總結
Tehshik P. Yoon教授課題組開發了一種銅催化的羧酸與各種氮、氧和碳親核試劑的氧化交叉偶聯策略。該體系利用原位生成的第一過渡金屬配位絡合物的固有光化學反應特性,並且無需外加貴金屬光氧化還原催化劑便可進行光活化。該反應體系不僅適用於多種羧酸鹽原料和親核試劑,而且為複雜結構候選藥物的合成和後期修飾提供了強大的工具。
Decarboxylative cross-nucleophile coupling via ligand-to-metal charge transfer photoexcitation of Cu (II) carboxylates
Qi Yukki Li, Samuel N. Gockel, Grace A. Lutovsky, Kimberly S. DeGlopper, Neil J. Baldwin, Mark W. Bundesmann, Joseph W. Tucker, Scott W. Bagley, Tehshik P. Yoon
Nat. Chem., 2022, 14, 94–99, DOI: 10.1038/s41557-021-00834-8
導師介紹
Tehshik P. Yoon
https://www.x-mol.com/university/faculty/108
(本稿件由吡哆醛供稿)