今日,生物技術公司Immunocore宣佈,美國FDA已批准其創新療法Kimmtrak(tebentafusp-tebn)上市,治療特定的葡萄膜黑色素瘤。新聞稿指出,這項批准創下了多個第一:它是FDA批准的首款治療不可切除或轉移性葡萄膜黑色素瘤的療法。它同樣是首款獲得監管批准的T細胞受體(TCR)療法,以及首款獲FDA批准的治療實體腫瘤的雙特異性T細胞接頭。
作為一款創新的雙特異性蛋白,Kimmtrak由兩部分融合而成:一端是具有高親和力的可溶性T細胞受體,另一端是抗CD3的免疫效應結構域。這款療法能特異性地靶向gp100,一種在黑色素細胞和黑色素瘤中表達的抗原。先前,這款“first-in-class”療法已獲得美國FDA的突破性療法認定、快速通道資格、孤兒藥資格、以及優先審評資格。
▲Kimmtrak的作用機理(圖片來源:參考資料[3])
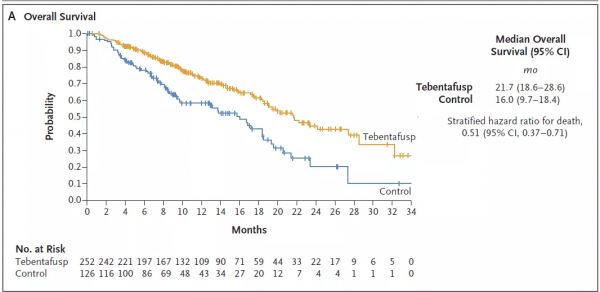
Kimmtrak的獲批是基於一項3期臨床試驗的結果。該試驗招募了之前尚未經過治療的葡萄膜黑色素瘤患者,他們均為HLA-A*02:01陽性。患者以2:1的比例被隨機分為兩組,前者接受Kimmtrak的治療,後者接受活性對照藥物的治療。去年9月於《新英格蘭醫學雜誌》上發表的資料表明,Kimmtrak作為一線治療,患者死亡風險降低49%(HR=0.51,95% CI:0.37, 0.71,p<0.0001)。Kimmtrak組的中位總生存期為21.7個月,活性對照組為16.0個月。安全性上,治療相關不良事件具有可控性。
▲Kimmtrak的3期臨床試驗總生存期資料(圖片來源:參考資料[3])
“Kimmtrak今日的獲批是具有歷史性的里程碑,也是Immunocore團隊、患者、以及我們的醫療健康合作伙伴數年來努力的結晶。在美國,每年都有數百人確診患有轉移性的葡萄膜黑色素瘤,他們之前沒有任何獲批的治療選擇。Kimmtrak是首款在罹患這一疾病的患者群體中展現生存獲益的療法,我們將專注儘快讓患者用上Kimmtrak,” Immunocore的執行長Bahija Jallal博士說道,“我們也很榮幸能開發世界首款獲批的TCR療法,我們相信這表明了我們平臺的強項,也為我們探索治療其它癌症和具有未竟需求的疾病的突破性TCR療法開啟了大門。”
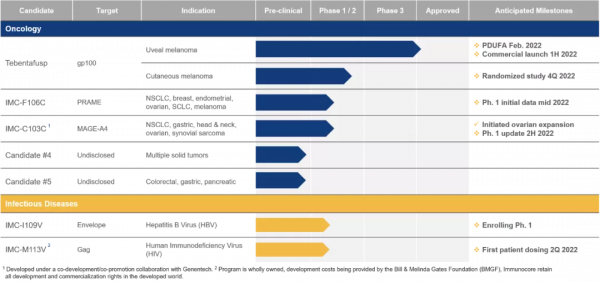
Immunocore的ImmTAC技術平臺專注開發一系列具有雙特異性的生物製品,使免疫系統能重新識別和殺死癌細胞。Kimmtrak是該平臺上誕生的首款療法。該平臺的其它在研分子具有類似的設計,將可溶性的T細胞受體進行改造,識別細胞內的癌症抗原,並透過抗CD3的免疫效應結構域,以極高的親和力與選擇性殺死這些癌細胞。由於T細胞浸潤人類腫瘤的能力,ImmTAC平臺上誕生的分子無需考慮腫瘤的突變負擔,就有針對實體腫瘤的潛力。這些分子同樣有潛力治療血液癌症。
▲Immunocore的研發管線(圖片來源:參考資料[4])
參考資料:
[1] Immunocore announces FDA approval of KIMMTRAK (tebentafusp-tebn) for the treatment of unresectable or metastatic uveal melanoma, Retrieved January 26, 2022, from https://www.globenewswire.com/news-release/2022/01/26/2373344/0/en/Immunocore-announces-FDA-approval-of-KIMMTRAK-tebentafusp-tebn-for-the-treatment-of-unresectable-or-metastatic-uveal-melanoma.html
[2] UPDATED: FDA hurries up a quick approval for the world's first TCR — after a 14-year R&D trek, Retrieved January 26, 2022, from https://endpts.com/breaking-fda-hurries-up-a-quick-approval-for-the-worlds-first-tcr-after-a-14-year-rd-trek/
[3] Nathan et al., (2021). Overall Survival Benefit with Tebentafusp in Metastatic Uveal Melanoma. NEJM, DOI: 10.1056/NEJMoa2103485
[4] Immunocore官方網站, Retrieved January 26, 2022, from https://www.immunocore.com/