爾雲間 一個專門做科研的團隊
原創 雲生信學生物資訊學
文獻解讀|期刊推薦|程式碼
鐵死亡|免疫浸潤|腫瘤微環境
非編碼RNA、外泌體以及自噬作為近年來CNS期刊和國自然當紅熱點,不僅受到主流期刊的青睞,論文發表勢頭強勁,同時也是國家自然科學基金等鼓勵申報的重要領域。如何搭上2022年的國自然熱點便車?“熱點整合”無疑是極富價值的一條路徑。
通常一篇最新文章J Extracell Vesicles(IF=25.841)可以拆分兩個國自然標書來完成。因此,近期我們總結了一些最新文獻,教大家如何將最新的報道,與自己的研究結合起來,形成自己的最新思路。同時,我們也將該文章在熱點整合方面的詳細研究設計思路及實驗內容分享給大家。
希望透過這篇國自然熱點話題文章的解析給大家帶來些許啟發,以期為大家成功中標2022年國自然盡上綿薄之力。
文獻題目:脂肪來源間充質幹細胞透過外泌體遞送miR-25減少中風小鼠的自噬
·研究背景
目前神經系統許多疾病仍無有效治療方法,應用幹細胞治療神經損傷,使神經元再生和神經功能恢復成為可能。幹細胞來源外泌體攜帶有助於細胞訊號傳導的miRNA、蛋白質等生物活性物質,對神經保護損有著積極影響,具有類似於幹細胞移植的治療作用。在腦缺血條件下,自噬對於神經元的存活是一把雙刃劍。誘導缺氧或腦缺血時適度誘導自噬可增強細胞活力和減少梗塞面積。然而,長時間的氧氣和葡萄糖剝奪或中風會導致過度自噬,進而導致顯著的細胞死亡。幹細胞外泌體誘導的中風神經保護作用及機制仍不十分清楚。這篇文章全面探索了幹細胞來源外泌體與神經保護的相關性。
·主要研究內容及結果
研究內容一 :ADMSC-EV保護神經元免受損傷功能研究
透過本部分實驗,明確ADMSC衍生的EV能夠保護神經元免受氧葡萄糖剝奪 (OGD) 損傷。
①ADMSC-EV 的純化、分離和表徵。
②將原代培養的神經元透過氧葡萄糖剝奪 (OGD)暴露,獲得OGD神經元損傷模型。
③ADMSC-EV可保護神經元免受OGD損傷,提高神經元存活率。
④Hrs-KD 和 GW4869 的處理抑制外泌體的生物發生,從細胞水平檢測是否ADMSC-EVs 對神經產生保護作用。
⑤構建MCAO小鼠模型。透過大腦中動脈閉塞(MCAO)誘導腦缺血動物模型,隨後透過右股靜脈插管進行注射ADMSC-EV治療,透過檢測小鼠梗塞體積、行為測試以及神經元密度等,從動物水平檢測ADMSC-EV對MCAO的神經保護作用。
【部分研究結果】
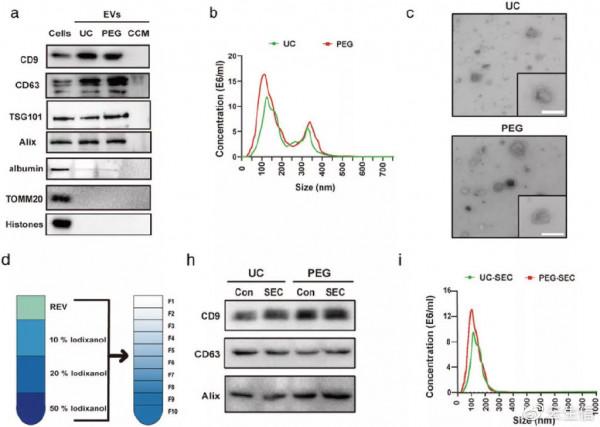
圖1. ADMSC-EV 的純化、分離和表徵:作者使用兩種成熟的方法(UC 和 PEG)從 ADMSCs 的條件培養基中富集 ADMSC-EV。完全細胞培養基以與條件細胞培養基 (CCM) 相同的基於 PEG 的方式處理,富集的 ADMSC-EV 的用透射電子顯微鏡 (TEM)、奈米顆粒示蹤分析 (NTA) 和蛋白質印跡法進行表徵。
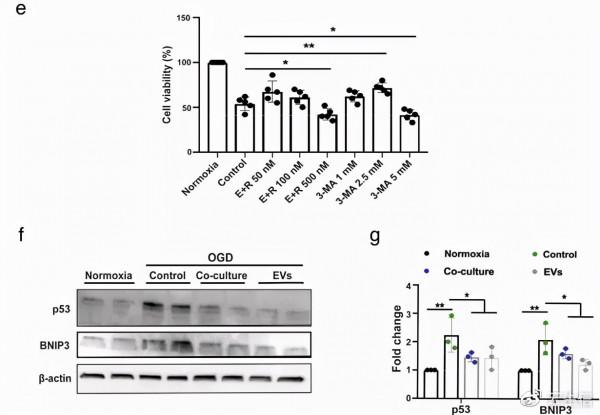
圖2. ADMSC-EVs 透過自噬調節保護神經元免受氧葡萄糖剝奪 (OGD) 損傷:首先是OGD氧葡萄糖剝奪後原代神經元的損傷呈現時間依賴性。作者使用自噬相關蛋白LC3-II 的表達來分析OGD模型中自噬水平。
圖3. EV可減少中風後腦損傷並改善神經功能恢復。作者研究了缺血條件下,EV的生物分佈,並對EV治療的MCAO動物腦損傷組織學和功能水平進行研究,其中包括腦梗塞體積、行為學及神經元存活率等。
研究內容二 ADMSC-EV保護神經元免受損傷的分子機制研究
透過本部分實驗,明確ADMSC-EV透過p53-BNIP3 訊號傳導減少自噬通量發揮保護神經元免受損傷的作用機制。
①將ADMSCs EVs與OGD誘導的原代神經元共培養體系用 BafA1處理,對自噬-溶酶體過程進行分析。
②在ADMSC-EV治療的OGD模型中,檢測自噬相關訊號級聯(包括p53 和 BNIP3)是否上調。從細胞水平檢測ADMSCs EVs治療對OGD損傷神經元的作用。
③自噬抑制劑3-MA 以及 BafA1分別治療MCAO小鼠模型。透過檢測神經功能恢復情況、神經元密度和自噬通量,研究自噬抑制對MCAO小鼠神經功能恢復的作用。
④透過注射ADMSC-EV治療MCAO小鼠,檢測p53 和 BNIP3 在體內的表達情況,進一步分析ADMSC-EV對自噬的調節作用。
【部分研究結果】
圖4. ADMSC-EVs 透過 p53 和 BNIP3 訊號傳導抑制自噬通量並增加細胞活力:作者使用自噬相關蛋白 LC3-II 的表達評估自噬水平。當原代神經元暴露於 OGD 並與 ADMSCs 共培養或用富含 UC 或 PEG 的 ADMSC 衍生的 EVs 處理時,中風誘導的 LC3-II 蛋白質丰度增加被逆轉。
研究內容三 ADMSC-EVs透過自噬抑制保護神經元的作用依賴於miR-25-3p
透過本部分實驗,明確ADMSC-EV治療後相關的自噬通量的下降是由EV遞送 miR-25-3p 介導的機制。
①在ADMSC-EV治療的OGD模型中,檢測miR-25-3p 的表達是否增強。
②用 RNase A、Triton X-100(以破壞囊泡的脂質雙層)處理 EV,透過 RT-qPCR 測量了 miR-25 的水平,進一步分析 miR-25位於囊泡內,受脂質雙層保護,免受RNase A 消化。
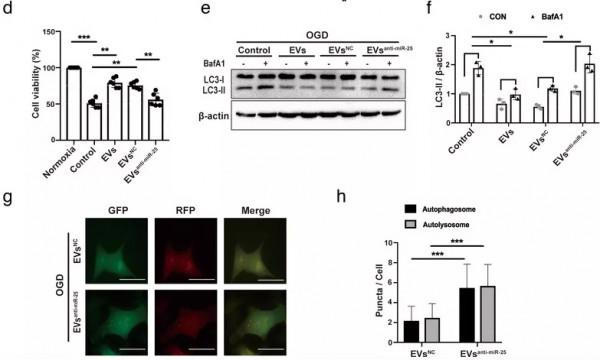
③用anti-miR-25-3p處理ADMSCs後分離的EVs,治療OGD,透過檢測細胞活力、自噬體和溶酶體數量,分析 miR-25-3p 對自噬調節的影響。
④利用miR-25-3p mimic和inhibitor轉染OGD神經元模型,檢測自噬調節和自噬通量的抑制情況以及p53 和 BNIP3 的水平,從細胞水平分析ADMSC-EVs 依賴於miR-25-3p抑制自噬來保護神經元免受損傷。
⑤在小鼠MCAO手術後注射PBS、ADMSC-EV、ADMSC-EV -miR25-3p(EVs anti-miR25),EVs NC預處理的 ADMSC-EVs,透過檢測自噬通量、神經功能恢復情況以及腦損傷面積,證實與 ADMSC-EV 給藥相關的自噬通量的下降是EV遞送 miR-25-3p 介導的。
【部分研究結果】
圖5. ADMSC-EVs 透過 miR-25-3p 調節自噬並誘導神經保護:作者在研究直接靶向 p53/BNIP3 自噬訊號通路的 miRNA中發現miR-25-3p是ADMSC-EV 中最豐富的miRNA 之一,為了證實 miR-25-3p 在EV 誘導的神經元 OGD 條件下的自噬調節中是否具有功能作用,用ADMSC- EV anti-miR-25 、ADMSC-EV NC 以及 PBS 處理OGD細胞,並給予BafA1誘導,檢測細胞活力以及LC3-II 積累情況。
圖6. ADMSC-EVs 中 miR-25-3p 的缺失減弱了中風後 EV 誘導的自噬和神經保護調節:用 PBS、ADMSC-EV、ADMSC-EV -miR25-3p 治療MCAO小鼠,評估自噬通量以及小鼠神經功能恢復情況。
·本文可借鑑的分析點
目前,MSCs衍生的EVs的神經保護內容物尚未得到充分鑑定,而自噬作為新的潛在神經保護治療靶點,其作用機制尚不明確。本文作者分析了在體外缺氧和體內腦缺血條件下,ADMSC-EVs 的應用是否會影響細胞存活和自噬反應的潛在機制。
作者圍繞近期熱點-幹細胞、外泌體非編碼RNA和自噬等,首先丟擲一個足夠吸引力的選題。另外,結合體內外實驗,多層次分析幹細胞外泌體非編碼RNA參與的神經保護過程。文章在機制中,補上了自噬通量在神經保護的作用,多熱點多角度進行分析,立項的創新性蹭蹭往上漲。
更值得一提的是,如果朋友們不知如何設計和撰寫研究內容,那麼,本篇文章的研究內容設計可以為大家提供一個框架。
首先,如果目標是申請國自然青年專案,可以參考本文的研究內容一和二,分別從細胞水平和動物水平進行功能研究和機制探索。其次,如果目標是國自然面上專案,可以借鑑本篇文章的整體研究內容。最後,祝2022年申請NSFC的朋友們,在2022年8月份金榜題名!
·國自然標書研究內容撰寫技巧
1. 在研究內容部分,需要講到你的假說透過哪些研究內容可以證明,寫出來即可!
2. 研究內容所包含的內容,要注意內容要集中,不能講一堆可有可無的工作量,以免被評審專家認為是工作量的堆砌。
3. 撰寫研究內容時一定要與研究方案區分開,不要寫的過於複雜和繁瑣,同時也不能太簡短,一兩句話就結束。
4. 撰寫研究內容時,要讓評委明白和清楚你要做什麼,層次要分明,從不同角度、層次和方面做工作。
參考文獻出處:Kuang Y, Zheng X, Zhang L, Ai X, Venkataramani V, Kilic E, Hermann DM, Majid A, Bähr M, Doeppner TR. Adipose-derived mesenchymal stem cells reduce autophagy in stroke mice by extracellular vesicle transfer of miR-25. J Extracell Vesicles. 2020 Oct;10(1):e12024.