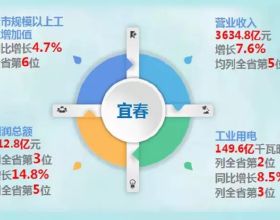
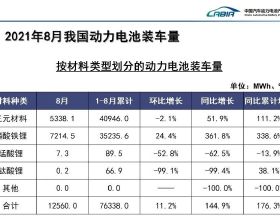
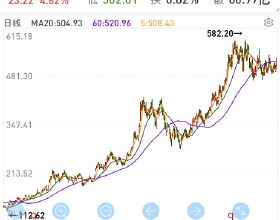
智通財經APP訊,迪哲醫藥(688192.SH)公告,公司產品DZD9008用於治療EGFR20號外顯子插入突變的非小細胞肺癌獲得美國食品藥品監督管理局(簡稱“FDA”)“突破性療法認定”。
公告顯示,DZD9008是公司自主研發的針對EGFR/HER220號外顯子插入突變設計的全球首創小分子化合物,首選適應症為治療EGFR20號外顯子插入突變非小細胞肺癌,目前處於國際多中心II期單臂關鍵性臨床試驗階段,正在中國、美國、韓國、澳大利亞、日本、法國等國家和地區開展臨床試驗。臨床前及臨床研究顯示DZD9008:
(1)具備高靶點選擇性,對已知EGFR突變型別均有效且對野生型EGFR抑制作用較弱(相比野生型EGFR,對T790M突變的選擇性達到50倍,對20號外顯子插入突變的選擇性達到3–10倍),較其他EGFR20號外顯子突變抑制劑競品,DZD9008具備更佳的臨床安全性;
(2)具備良好的藥代動力學資料:人體半衰期長達到約50小時,且PK曲線平緩,藥物峰值和谷底濃度差小有利於降低由於藥物峰值濃度過高帶來的不良事件發生;
(3)臨床療效優異:截至2021年7月30日,全球臨床試驗結果顯示,DZD9008在200mg/日和300mg/日劑量下,確認的最佳客觀緩解率(ORR)分別達到45.5%和41.9%,並在腦轉移患者及強生Amivantamab療效不佳或治療後進展的患者中均顯示療效。