惰性非霍奇金淋巴瘤(iNHL)主要包括濾泡性淋巴瘤(FL)和邊緣區淋巴瘤(MZL),其臨床過程具有異質性,一般病程遷延,目前仍難以治癒;在早期疾病進展和復發的患者中,當患者對二線和三線治療的反應欠佳時,其轉化為侵襲性淋巴瘤的風險較高,因此需要新的治療方法。Axicabtagene Ciloleucel是一種自體靶向CD19嵌合抗原受體(CAR)-T細胞療法,在復發或難治性B細胞急性淋巴細胞白血病以及瀰漫性大B細胞淋巴瘤患者的治療中具有里程碑式的意義,且目前已獲批上市,為上述患者帶來的新的治療希望。既往有研究表明,靶向CD19 CAR-T細胞治療可能為iNHL提供臨床獲益。基於此,有研究者開展了ZUMA-5試驗,以評估Axicabtagene Ciloleucel治療複發性或難治性iNHL(R/R iNHL)的療效和安全性。
研究方法
ZUMA-5是一項多中心、單臂、II期臨床試驗,納入了來自美國的15家癌症醫療中心和法國的2家癌症醫療中心的患者。入組的患者為組織學確診的iNHL成人患者(≥18歲),包括1–3a級FL、淋巴結或結外MZL,複發性或難治性疾病定義為既往接受過≥2線治療,必須包括抗CD20單克隆抗體聯合烷化劑。最近一次既往治療完成後6個月內的疾病進展定義為難治性。患者接受白細胞單採以獲得用於生產Axicabtagene Ciloleucel的T細胞,隨後在第-5、-4和-3天接受環磷醯胺500mg/m²/d和氟達拉濱30mg/m²/d預處理化療;第0天患者接受Axicabtagene Ciloleucel單次靜脈輸注,目標劑量為2×106CAR-T細胞/kg。主要終點是由獨立放射學審查委員會根據Lugano分類評估的總緩解率(ORR),包括完全緩解(CR)和部分緩解(PR)。
研究結果
試驗流程與患者基線特徵
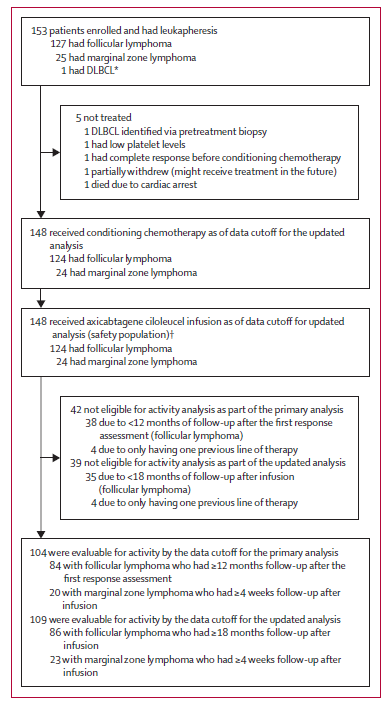
ZUMA-5試驗在2017年6月20日至2020年7月16日期間篩選了181例患者,共有153例患者(127例FL、25例MZL和1例後來確定為DLBCL)入組並接受了白細胞單採,所有入組患者均成功生產了Axicabtagene Ciloleucel(詳見圖1)。患者從白細胞單採至Axicabtagene ciloleucel遞送至試驗中心的中位時間為17天。主要分析的資料截止日期為2020年3月12日,更新分析的資料截止日期為2020年9月14日。所有148例接受治療的患者(更新分析人群)中,大多數既往接受過至少三線治療,高危疾病特徵常見;MZL患者中年齡≥65歲且患有IV期疾病的比例高於FL患者,從診斷至白細胞單採的中位時間為5.1年。最近一次既往治療開始後的中位至疾病進展(PD)時間為8.2個月。148例患者中的6例(4%)接受了橋接治療;4例為FL,2例為MZL,橋接後所有患者均有可測量的疾病。
療效
該研究的主要活動分析的中位隨訪時間為17.5個月。104例iNHL患者符合主要分析條件(84例FL和20例MZL)。根據獨立審查委員會對符合方案人群主要分析的評估,104例患者的ORR為92%(95% CI 85%-97%),其中CR率為74%。84例FL患者的ORR為94%(95% CI 87%-98%),CR率為79%;20例MZL患者的ORR為85%(95% CI 62%-97%),CR率為55%。為了評估Axicabtagene Ciloleucel緩解的永續性,研究者們進一步對患者輸注後18個月隨訪進行了預先規定的更新分析,中位隨訪時間為23.3個月(FL患者的中位隨訪時間為2.4個月,MZL患者的中位隨訪時間為17.3個月)。在更新分析人群的可評價患者中,獨立中心審查評估的109例患者的ORR為92%,其中FL和MZL患者ORR分別為94%和83%。經獨立中心審查評估,患者CR率為76%,包括86例FL患者中的68例(79%)和23例MZL患者中的15例(65%)(圖2)。17例(16%)患者達到PR。在歸類為無疾病或狀態未知的5例(5%)患者中,根據獨立中心審查,4例患者在基線時或基線後無疾病,但研究者認為有疾病,1例FL患者在首次疾病評估前死亡(圖2)。
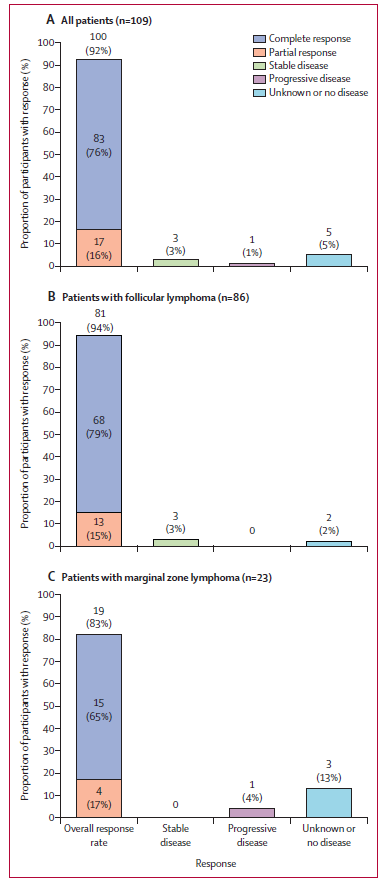
圖2:更新分析中所有患者(A)、FL患者(B)和MZL患者(C)接受Axicabtagene Ciloleucel治療後的ORR
截至更新分析的資料截止日期,109例患者中的64例患者持續CR,其中FL患者為62%,MZL患者為48%。在83例獲得CR的患者中,73%的患者在資料截止時仍處於緩解狀態,其中FL患者比例為74%,MZL患者的比例為73%。截至資料截止日期,26例FL患者中的13例在第4周由初始PR後轉為CR,13例患者中的12例仍保持CR。18個月時,預估維持CR的患者比例為65.6%(95% CI 53.9%–75.0%),預估的無進展生存(PFS)率為64.8%(95% CI 54.2%–73.5%),預估的18個月總生存(OS)率為87.4%(95% CI 79.2–92.5)(詳見圖3)。

圖3:患者的緩解持續時間(A)、PFS(B)和OS(C)情況
安全性
該研究中患者最常見的≥3級不良事件(AE)為血細胞減少(70%)和感染(18%)。≥3級細胞因子釋放綜合徵(CRS)的發生率為7%,3級或4級神經系統事件發生率為19%。50%的患者發生了任意級別的嚴重不良事件(SAE)。3%的患者因AE死亡,其中1例被認為與治療相關。
研究結論
該研究結果表明,Axicabtagene Ciloleucel治療為既往接受至少兩線治療絕大部分R/R iNHL患者中提供了持久的臨床獲益,且具有可控的安全性。根據該研究結果,Axicabtagene Ciloleucel於2021年3月5日在美國獲批,用於治療既往接受過二線全身治療的R/R FL成人患者。
參考文獻:Caron A Jacobson , Julio C Chavez , Alison R Sehgal, et al. Axicabtagene ciloleucel in relapsed or refractory indolent non-Hodgkin lymphoma (ZUMA-5): a single-arm, multicentre, phase 2 trial. Lancet Oncol. 2021 Dec 8;S1470-2045(21)00591-X. Online ahead of print.