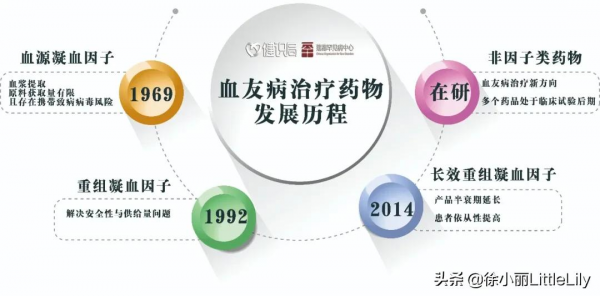
2018年9月,英國BBC揭開了一樁埋藏數十年的驚天醜聞:上世紀70年代-80年代,有近5000名血友病或其他患者,在接受英國公立醫療系統(NHS)的血液治療後,感染了艾滋病和丙肝,其中近3000人因此死亡。
NHS的這批血漿產品包含了凝血八因子,進口自美國,血漿來自美國4萬多名獻血者,其中不乏吸毒罪犯及攜帶有血液病毒的患者。
無數的無辜生命換來的,是產業升級:八因子生產商不得不將人血漿來源轉換為DNA重組來源。
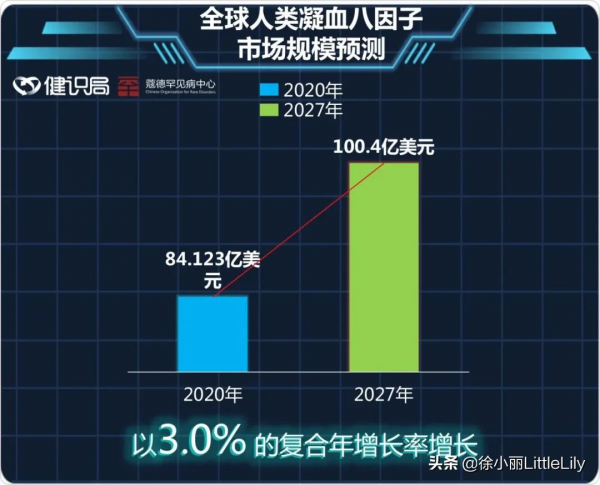
血友病是人類最早發現的罕見病之一,人類已經與之鬥爭了近兩個世紀。有預測稱,2020年,全球人類凝血八因子市場規模為84億美元,且以3.0%的複合年增長率增長,預計到 2027年將達到100億美元。
這種藥物生產難度大、供應不足、價格昂貴。到了21世紀,更先進的血友病基因療法臨床試驗正在推進中。
得一斑窺全豹,血友病藥物開發史,也是罕見病藥物產業從無到有、從小到大的歷史。
英國皇室病
血友病曾被稱為“皇室病”,最早出現在英國皇室維多利亞女皇家族。
維多利亞子孫眾多,與歐洲皇室聯姻頻繁,因此血友病基因傳遍歐洲皇族。當時的德國國王、法國國王、俄國國王等都與英國皇室進行過通婚,導致整個歐洲皇室成員身上或多或少出現了“bug”。
血友病是一種遺傳性凝血功能障礙的出血液性疾病,患者通常為男性。在醫學蠻荒年代,血友病被視為“洪水猛獸”,因為稍有磕碰,身體就會受傷出血,而且很難停下來。
發展到最後,患者身體內部也會“自發性”出血,嚴重時可能會危及生命。
在那個時代,即便是皇室,面對血友病也只有認命的份兒。
直到20世紀早期,美國醫生凱斯·布林霍斯證實了多數血友病的致病原因:缺乏凝血因子VIII,即俗稱的八因子;不久,美國的生物化學家愛德溫·康恩發明了分離血漿成分的方法,成功從血液中提取到了凝血八因子。
凝血八因子是人類第一個攻克的罕見病成果。提取凝血因子最初需要人的血漿。二戰時期,戰場需求促進了全球血漿、血製品產業的興盛。
1931年成立的美國製藥企業百特(Baxter)順勢改行,由最初生產靜脈注射溶液轉身做起了集採儲存血液的專用容器,並順道生產血製品。上世紀60年代前後,百特開始生產八因子。
彼時,美國血製品行業早期亂象叢生,經常出現“血汙染”醜聞,有不少患有血友病患者在使用血製品後感染了HIV或丙肝病毒。
據當時的調查記錄,血液汙染的根源在於醫療工作人員、醫藥公司以及政府監督部門的相互勾結和依附。事實上,當時病毒滅活的不完善也是根本因素。
血友病患病群體並不算多,但政府和社會的背叛,讓他們空前團結。他們強烈譴責該事件中的相關利益方,呼籲更安全有效的血友病治療方法。
直到1983年《孤兒藥法案》推出,醫藥企業才完成了質變的飛躍。
小病種,大產業
鑑於血液汙染醜聞爆發,包括百特公司在內的入局者不得不考慮尋找新的增量。
1992年,百特研發的重組八因子產品上市,這是一種人工合成的八因子產品,不以血液為原料,徹底規避了血源汙染的問題。
此後,各種型別的重組凝血因子產品紛紛登場。拜耳、輝瑞、諾和諾德也都加入到了同一賽道。賽諾菲也通過於2018年收購專攻血液罕見病治療的Bioverativ加入進來,而Bioverativ於2016年剝離自渤健(Biogen)。
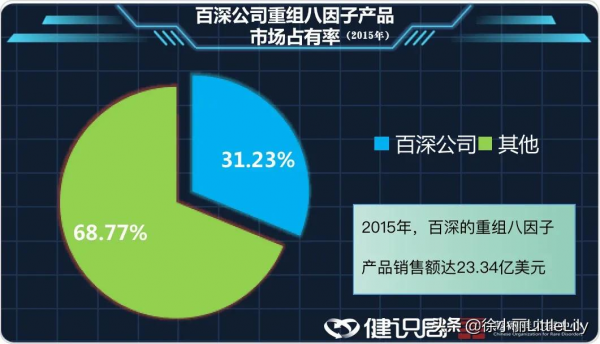
2014年,在全球醫療醫藥競爭加劇的情況下,百特將自身的血製品業務剝離出來成為新公司百深(Baxalta)。2015年,獨立後的百深重組八因子產品銷售額達23.34億美元,市佔率達31.23%。
同佈局在罕見病領域的夏爾公司(Shire),看到了百深在血友病領域的優勢。彼時,夏爾已在免疫系統疾病、遺傳疾病、神經系統疾病、胃腸道與內科疾病及腫瘤疾病有所佈局,這些也都是靠多年來不斷“買買買”成型的。夏爾的打算是,如果能在血液疾病領域插上自家旗幟,將有利於罕見病領域的拓深。
眾所周知,罕見病市場的吸引力並不在於其市場廣闊,而在於其增速遠快於整體醫療市場。2016年1月,夏爾以320億美元的價格正式達成了對百深的收購。高額的收購價格,使夏爾欠了一屁股債。
夏爾的窘境,被同樣看上罕見病市場的武田看到。2019年1月,武田以640億美元的價格將夏爾收入囊中,並藉此一腳踏入全球十大製藥公司之列。
時至今日,罕見病藥物領域還在不斷髮生併購。2021年9月30日,默沙東以115億美元收購 Acceleron製藥,後者的主要候選藥物是處於3期臨床試驗 Sotatercept,這是針對進行性的、危及生命的肺動脈高壓的藥物。
2021年7月6日,阿斯利康(AZ)擬以390億美元收購Alexion公司獲歐盟委員會許可。Alexion是罕見病創新藥開發公司,其主要產品用於治療陣發性睡眠性血紅蛋白尿症、非典型溶血性尿毒綜合徵、全身型重症肌無力和視神經脊髓炎譜系障礙。
產業繁榮的背後
如今,儘管還有人血漿來源的八因子在用,但DNA技術開發的重組人凝血八因子才是血友病患者主要的救命依賴。在美國,大約75%的血友病患者使用重組八因子產品,美國人的消耗量也佔據了全球市場的46%。
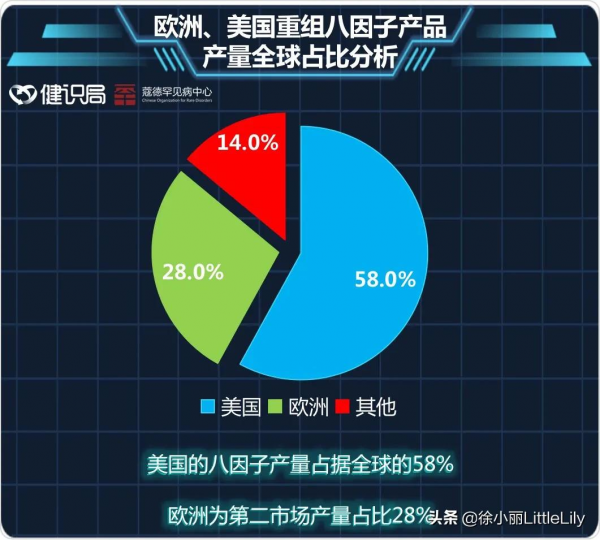
目前,美國的八因子產量佔據全球的58%。歐洲為第二市場,其銷售和生產佔比分別為36%和28%。亞洲市場的這兩個資料分別為11%和10%。
如今的八因子產業,被百特、拜耳、杰特貝林(CSL Behring)、輝瑞和基立福(Grifols)巨頭壟斷性佔據。
罕見病藥物研發最大問題是發病群體較小,很難進行透徹的病理研究,因而也就很難研發出對症的藥品。作為不那麼“罕見”的罕見病,血友病發病率也不超過萬分之一。
罕見病藥物的臨床試驗成本居高不下,要知道,每個成功上市的新藥僅臨床試驗一項就耗費約9300萬美元。
此外,罕見病的資料分享、每年疾病發作頻率、治療過程的長度以及患者流動性等都是臨床試驗難題。
藥企首先尋求政策助力。在重組凝血因子產品的研發過程中,《孤兒藥法案》也在不斷修正。自頒佈以來,FDA對《孤兒藥法案》進行了近4次完善,還透過其它多種舉措來進一步刺激藥企研發孤兒藥的熱情。尤其在2017年,FDA釋出了“孤兒藥現代化計劃”,要求在90天內處理超期孤兒藥資格申請。
審批時間縮短,也就意味著上市時間有望加快。這對於時間就是金錢的製藥企業來說,是創造收入的好機會。
除了《孤兒藥法案》,美國還從提供罕見病藥物的研究建議、稅收抵免、費用減免和市場獨佔期保護等方面激勵企業研發積極性。
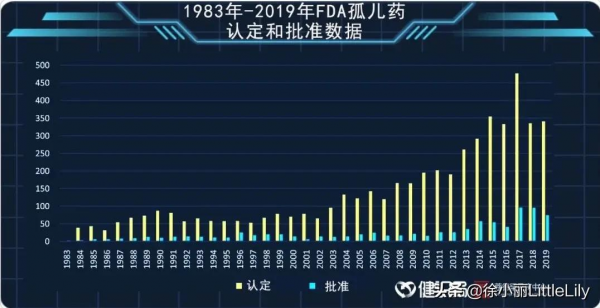
政策端扶持基調定下,自1983年以來,FDA授予的孤兒藥資格數量和批准的孤兒藥適應症逐年遞增。
有資料顯示,1983年到 2020 年,美國FDA 共批准了 800多個孤兒藥,平均每年批准 23 個。其中 2018 年批准數量高達 94 個,為歷年最高。而1973 年至 1983 年間,只有10種孤兒藥獲批上市。
資料來源:
https://ojrd.biomedcentral.com/articles/10.1186/s13023-021-01901-6/figures/2
孤兒藥價格仍然高昂。2018 年,前100名孤兒藥的每名患者每年的中位費用為 超過10萬美元,這個數字是非孤兒藥中位價的7倍。史上最貴的療法是名為Zolgensma的脊髓性肌萎縮症基因療法藥物,來自諾華製藥,於2019年獲批。
在這些孤兒藥中,腫瘤治療藥物是研發的主要方向,佔據了上市藥物種類的三分之一,接下來的研發領域集中在消化系統(或新陳代謝)、神經系統、血液及造血系統。
然而,已知7000多種罕見病中,僅不到5%獲得了有效的療法。在中國第一批罕見病目錄的121種疾病中,只有60%有藥可醫。不過鑑於罕見病多為致病機理較為清晰的病種,因此攻克難度較小。
《孤兒藥法案》所引發的罕見病藥物的研發熱情,自然也令其他國家紛紛效仿。其中日本、澳大利亞、歐盟分別於1993年、1997年和1999年頒佈了類似法案。
政策利好,利益在前,市場藍海,這讓不少企業投身於罕見病研究,向FDA進行孤兒藥資格申請在全球也逐漸成風。
還以血友病為例。近來,各種長效凝血因子產品和非因子類產品相繼問世,部分產品已經在中國上市。如2021年4月,賽諾菲注射用重組人凝血因子產品獲國家藥監局批准,這也是國內首個長效重組凝血九因子新藥。
如今,全球性的生物技術公司BioMarin已經在開發治療血友病的創新療法,今年5月公佈了一份長達5年的臨床資料稱,其藥物valrox單次輸注後5年,年均出血率減少95%。這是一種基於腺相關病毒的基因療法,用於A型血友病的治療,也是全球第一款進入監管審查的血友病基因療法。
直到2021年,中國才出現第一款國產重組凝血八因子產品,那麼我們的罕見病產業如何前行,或許能夠從美國血友病產業發展中找到思路。
2002年,山東一名小女孩因肝病陷入昏迷。小女孩的父親透過網路向中國臺灣的“亞洲換肝之父”陳肇隆求救,表示願意割肝救女。
陳肇隆看到訊息,立刻帶領團隊飛往北京協和醫院,完成了活體肝移植手術。
小女孩活了下來,她的身體不同尋常——無法正常代謝銅元素,銅在肝臟沉積,最終造成肝損傷。這種患兒又稱作“銅娃娃”,如果能夠在早期確診,就能服用銅螯合劑,有效阻止疾病發展。
然而,“銅娃娃”們罹患的是一種罕見的遺傳病,發病率低至1/20萬。大部分“威爾森氏症”患者幾經輾轉,最終得到確診時,肝臟損害往往已經到了不可逆的階段,只能寄希望於肝移植。
事實上,“威爾森氏症”早在1956年就有成熟治療方法,只是當時在中國大陸的研究遠遠不夠。
眼看著這種局面,上海新華醫院教授李定國有點坐不住了。
關鍵一步
從上海一名廠醫起步,李定國在1978年透過高考改變了自己的命運。1981年,35歲的李定國才如願以償,大學畢業後留在新華醫院消化內科工作。
李定國或許不是第一個對威爾森氏症感興趣的醫生,但這個病給他深深的觸動。這是少數能夠治療的罕見病,而且越早治療效果越好。如果能夠及早發現患者、及早開展治療,就能救人一命。
臺灣罕見病基金會會長陳莉茵曾這樣告訴李定國:“我們不可能照顧他一輩子,但制度可以。”這句話打動了李定國,也讓他為推動罕見病醫療和社會保障奉獻了全部精力。
2004年開始,作為上海市政協委員的李定國就開始不斷與各級政府部門就罕見病話題展開討論,希望開展罕見病醫療保障。2009年,在一次內部研討會上,時任上海市副市長、兒科頂尖專家沈曉明終於給李定國一個明確的答覆:
“搞清三個問題:1、罕見病的定義;2、上海有多少罕見病;3、需要多少錢。”
有了這三條主線,李定國的工作就有了方向,“罕見病防治不是少數人的事”,這至少在上海市政府層面已經形成共識。
在李定國的努力下,上海市政協和九三學社在2010年連續組織了兩次罕見病醫療保障專題研討會,地方立法工作也隨後展開。
2011年2月28日,世界罕見病日前夕,上海醫學會罕見病專科分會成立,李定國成為第一屆主委。
這是中國第一個省級醫學會之下的罕見病專科學會。
罕見病學會,不止治病
2018年5月,國家衛健委、藥監局、工信部等5部門聯合印發《第一批罕見病目錄》,共涉及戈謝病、龐貝病、法佈雷病等121種罕見病。這是中國第一部關於罕見病的目錄,為全國醫療機構開展罕見病的預防、篩查、診斷、治療和康復提供理論依據。
醫學學會、協會是醫學科技工作者交流業務的平臺,有助於促進醫學技術進步,促進醫學技術普及和推廣,促進醫學隊伍的成長。
各專科分會則是醫學學會具體開展各專業領域的基礎。中國最大的醫學學會“中華醫學會”,旗下有88個專科分會,最早的一批分會成立於1937年,而數字醫學、組織修復與再生等新興醫學領域的分會,則是近幾年成立的。
成立罕見病分會,其實是有一定難度的。
罕見病是個集合概念,包括至少上百種疾病,雖然每種罕見病患者人數不多,各種病患加起來,數量十分龐大。這些患者病況不一、所涉的專業迥異,因此用一個學會來包含所有罕見病的研究,難度很大。
在上海醫學會罕見病專科分會的成立儀式上,李定國表示:“國內罕見病的研究將由以往分散狀態逐步向有學術組織協調的基礎和臨床研究方向發展,有利於提高罕見病的篩查和診斷水平,有利於推進罕見病基本醫療保障體制的建立。”
從這番表述來看,罕見病學會的重要目標有三個:改變此前分散研究的狀態;儘量提高罕見病的診斷篩查;同時推動罕見病保障體系。
此後各地陸續建立的罕見病學會里,“罕見病醫療保障體系”成為很多學會目標之一,這顯然已經超出了醫學技術研究的範疇,而擴大到更廣泛的社會領域。
罕見病患者需要得到救治,更需要得到有保障的救治。因為病例稀少,無論是醫生還是製藥企業,開發罕見病的治療方法和技術都面臨著巨大的成本和有限的收益。這是無法調和的矛盾,沒有中間路線可走。
患者、醫生、藥企、保險、社會,五方只有“各讓一步”,才有可能實現罕見病患者的有效保障。醫生站在診療的第一線,很早就認識到了這個問題,所以承擔起了社會和政策教育的工作。
努力17年,立法不易
2019年2月,在多路專家大力呼籲之下,國家衛健委遴選324家醫院組建罕見病診療協作網,建立雙向轉診、遠端會診制度。
罕見病立法,其核心也就是罕見病保障的問題。李定國等多位學者一直在透過自己的社會身份,在各種渠道呼籲建立罕見病的專門法律。
2006年,全國人大代表安徽大學教授孫兆奇多次與其他人大代表一起,提交“關於制定《罕見病防治法》的議案”。
當時的勞動和社會保障部回覆:“國家相關部門將盡快制定我國罕見病定義、範圍及診療規範等標準。”
但這一“儘快”,就“儘快”了十多年。直到現在,各項工作也只能說“在進行之中”“適時出臺《罕見病防治法》”。
美國的《孤兒藥法案》也經歷了漫長的立法和透過實踐,中間幾次提案均遭到否決。最終起了助力作用的是一位好萊塢著名影星,曾主演《十二怒漢》的傑克·克里格曼。
1980年,美劇《法醫昆西》中講述了法醫昆西推動罕見病藥物立法的故事。這是克魯格曼根據當時社會熱點事件改編的,一名罕見病患兒的母親不斷透過社會組織、議會等機構,試圖讓藥企開發圖雷特綜合症(也被稱為抽動症)的藥物。
電視劇中的法醫最終成功說服美國國會,促成了罕見病藥物立法。現實中的克魯格曼也得到了大量有社會影響力人士的支援。1983年1月4日,時任美國總統里根終於在《孤兒藥法案》上籤了字。
目前,美國、歐盟、澳大利亞、日本、韓國以及中國臺灣省都相繼制定了罕見病相關法案,很多國家和地區的罕見病患者享有政府醫療保健計劃和商業保險雙重保障,罕見病患者只需要負擔非常少一部分費用,或者不需要負擔任何費用。
目前,國內一些省市已經將一些較為“常見”的罕見病,如戈謝病(一種影響糖脂代謝的遺傳病),納入了地方大病保障和特藥救助範圍。如上海在李定國等醫生的推動下,2011年開始就有12種可治療的罕見病被納入報銷範圍。
國家層面也有了一系列舉措。迄今,國家衛健委釋出了第一批罕見病目錄,印發了《罕見病診療指南》,建立了罕見病診療協作網,建立了罕見病病歷診療資訊登記制度。
未竟的事情還很多。今年2月9日,國家衛健委在全國人大《關於加快推進罕見病治療醫療保障機制的建議》答覆中稱,中國罕見病用藥供應保障受經濟、人口、社會保障水平等條件制約,仍處於起步階段,面臨一些挑戰。
下一步,國家衛健委將加強罕見病用藥使用環節的監測,將符合條件、臨床急需罕見病用藥列入鼓勵仿製藥品目錄或鼓勵研發申報兒童藥品清單,透過新藥專項等國家研發專案支援企業和科研單位研發,並積極配合有關部門完善罕見病醫療保障、藥物可及性等相關管理政策,進一步保障罕見病患者權益。
從2004年至今,李定國已為“銅娃娃”們奔走17載。一位醫生的職業生涯沒有幾個17年,絕大多數罕見病患者也等不起17年。
1990年,家長髮現,年僅兩歲的鄒正濤不對勁。孩子的肚子逐漸鼓起,鼓成一個皮球。這種怪病差點逼瘋了年輕的父母,他們帶著幼子四處尋醫問藥。最終,北京兒童醫院血液中心確診:
鄒正濤是北京發現的第二例戈謝病患者。
由於基因突變,鄒正濤體內的葡萄糖腦苷脂貯積,形成 “戈謝細胞”,體徵上表現為肝脾腫大,肚子異常突起。
據報道,在中國,戈謝病的患病率約為1/50萬~1/20萬,大概只有全球平均水平的三分之一。患病率的差異,很可能與實際確診數不足有關。
鄒正濤是不幸的,他被最多1/20萬的患病率擊中;他又是幸運的,他可能是中國最早一批得到確診的戈謝病患兒,而且在北京確診,得到了當時世界上最好的治療藥物。
1994年,一款戈謝病治療藥物“注射用伊米苷酶”獲得美國FDA批准上市。兩年後,鄒正濤就用上了這款藥,代價是“幾乎傾家蕩產”。
就在鄒正濤一家絕望的時候,世界健康基金會與“注射用伊米苷酶”的研發企業啟動了救助專案,對包括鄒正濤在內的134名中國戈謝病患者提供無償藥品援助。
“那時我彷佛看到天使降臨。”11歲那年的記憶,清晰地留在了鄒正濤的心裡。如今他順利長大成人,成為兩個孩子的父親,如常人一樣過著平凡而珍貴的生活。
發自於1999年的救助專案已持續20多年,截至2021年7月,已向中國的戈謝病患者無償提供了超過20億元的藥品。
20年來,針對戈謝病的探索是中國罕見病領域的啟蒙課,讓越來越多的人瞭解罕見病、關注罕見病、逐步解決罕見病問題。
發自初心,借力政策
上世紀80年代,美國波士頓颳起一股“學術創業風”。其中,麻省理工教授哈維·洛迪什(Harvey Lodish)聯合一群高知好友,創辦了健贊公司,攻關方向定位在了鮮為人知的戈謝病。
之所以聚焦於戈謝病,只因為哈維和他的夥伴們所掌握的生物技術有望解鎖戈謝病難題。這是一場“理想主義”的試水,但結局驚豔。
歷經10餘年打磨,哈維團隊大獲成功。他們研發的“注射用伊米苷酶”,成為當時全球唯一一款戈謝病藥物,並於1994年成功透過FDA審查上市。
傳奇,往往誕生在那些抱著樸素初心的人物身上。這款戈謝病藥物上市的15年後,哈維的孫子確診了戈謝病,正是因為有解藥,他的孫子得以健康成人。
以患者為中心,是罕見病奇蹟誕生的基礎。但要持續在罕見病領域技術創新,讓患者有藥可用,政策的激勵至關重要。
罕見病與其它病種的區別正在於罕見,支付診療體系不完善。比起患病人數動輒上萬、上十萬的腫瘤病種,許多超罕疾病全國僅有數百名患者,罕見病藥品除了研發成本、生產成本、推廣成本等,往往還需要患者援助和篩查診斷等額外成本,所有成本分攤到極少數患者頭上,其單人價格往往非常高昂。“就像其他消費品一樣。罕見病藥物如果成本很高,使用的人還少,企業的研發和生產很難得到回報,就會缺乏動力,從而導致市場失靈。”全國政協委員、上海交通大學公共衛生學院教授馬進曾對媒體坦言。
1983年,美國通過了《孤兒藥法案》,這是世界上第一部罕見病領域的法案。從結果來看,自《孤兒藥法案》頒佈後,FDA已經批准了超800種罕見病藥物上市,與頒佈前僅有38種相比,增加了20倍有餘。隨著《孤兒藥法案》的不斷完善,大型製藥企業紛紛入局罕見病領域,武田、默克、賽諾菲、輝瑞均在其列。
在各界對於罕見病的界定還未有定論時,《孤兒藥法案》首先給出了罕見病的界定,同時從新藥申請費豁免、審批綠色通道、市場獨佔權,定價及保險支付等方面,均給予了罕見病藥物研發企業激勵政策。
不少罕見病藥企巨頭受惠於《孤兒藥法案》,美國罕見病領域逐漸火熱起來。成熟的商保支付體系和諸多州對患者權益的立法保護,也顯著減輕了罕見病患者的壓力,使產業進入良性迴圈。很多國家緊隨其後,也頒佈了孤兒藥相關政策。
如日本1993年頒佈的《罕用藥管理制度》,給予日本國內研發罕見病藥物的企業10年的市場獨佔權。該制度實施後的6年裡有43個罕見病用藥得到獲批,幾乎和過去13年批准藥物持平,罕見病用藥在新藥總數中的比例也達到19%,此前13年這個比例不超7%。
探索之餘,仍有困境
國外的相關政策不可能照搬到國內,中國對於罕見病領域的探索仍在路上。
早期,國內解決罕見病患者的治療問題,大部分都依賴慈善捐助,例如1999年健贊開啟的贈藥專案。然而,這種出於企業自身的義舉,顯然不是解決問題的根本途徑。
企業也在尋求破局之路,即協同各方,逐步建立支付與診療體系。
若以賽諾菲健贊作為一個樣本,可見罕見病企業對於中國的診療體系建設付出了全方位的努力。2011年,法國製藥巨頭賽諾菲以201億美元收購了健贊。次年,在國內罕見病診療體系還幾乎一片空白時,賽諾菲開始培訓全國4家醫院實驗室檢測溶酶體貯積症。在接下來的幾年裡,先後組織專家推動了中國戈謝病、龐貝病、法佈雷病的診療專家共識釋出,大大促進了這些罕見病的規範化治療。
過去的五年中,賽諾菲健贊還資助開展溶酶體貯積症高危篩查公益專案。至今,專案已送檢近萬例疑似患者,三百餘名患者獲得確診,降低了罕見病的誤診與漏診。
國內罕見病生態的發展,還得益於國家相關政策的重視。
2017年,國務院釋出《關於深化審評審批制度改革鼓勵藥品醫療器械創新的意見》,明確提出支援罕見病治療藥品醫療器械的研發,同時允許企業減免臨床試驗。
2018年,五部委聯合釋出了國內首批罕見病目錄。三年時間,已有成效。2021年12月18日召開的中國罕見病大會上,國家醫療保障局副局長李滔指出,截至目前,國內共有60餘種罕見病用藥獲批上市,其中已有40餘種被納入了國家醫保目錄,涉及25種疾病。當天大會上,國家藥品監督管理局陳時飛副局長介紹,2021年中國批准了10個罕見病藥品,用於治療脊髓性肌萎縮症、青年帕金森、高氨血癥等罕見病。
國家相關政策的相繼出臺,加快發展並完善了中國罕見病防治和保障體系。近年來,更多的企業加入了罕見病領域,其中不乏立足中國、放眼世界的國內藥企。
然而,探索之餘,仍有困境。
即使生態發展已有長足進步,罕見病領域仍然長期存在診斷難、治療難、用藥難的困境。一個繞不過去的命題是,由於罕見病藥品研發生產成本高,患者人群又很少,藥品定價往往較高。此外,為生態付出的診療網路建設和患者服務,對企業也是不小的成本。因此,解決支付問題是關鍵。
縱觀發達國家或中等發達國家在罕見病支付方面的歷程,一般在人均GDP超過一萬美元時期解決高值藥物問題。我國經濟發展已突破均GDP一萬美元的水平,各地政府透過積極探索罕見病的醫療保障路徑,也形成了具有各自特點的罕見病保障模式。
以戈謝病為例,從2009 年“注射用伊米苷酶”在中國上市,到目前上海、浙江、江蘇、山東、山西、湖南、陝西以及寧夏回族自治區等省市已將戈謝病納入了罕見病專項基金或大病醫保、醫療救助制度,各地探索出“多方共付”的模式來解決包括戈謝病在內的罕見病醫療保障問題。這是從零到一邁出的一大步。
見微知著。戈謝病各地的保障模式,是否對政府設計全國性罕見病保障政策有借鑑意義?戈謝病已經進入12個省市醫保,那麼摸清各省治療患者人數、醫保後患者增長情況、醫保基金的影響以及診療協作網的建設,便可以為未來罕見病保障政策出臺提供依據。
舉例來說,2013年上海就已將戈謝病納入地方醫保,然而近10年過去,目前上海治療的戈謝病人僅有6名,多年沒有新增患者。超罕病,雖然單人費用高昂,但人數極少,總費用有限,對醫保基金的影響有限可控。
而對產業創新而言,如果對相關藥品沒有差異化待遇的機制,那麼入局研發的企業也將難以避免“積極性受損”的結局。藥企“積極性受損”的最終結果,是難以為患者提供可持續的整體解決方案,也將影響藥物引入,乃至患者“無藥可醫”。
當市場和患者陷入兩難,政策的激勵便十分重要。比如,在市場失靈的大背景下,是否可以出臺差異化的藥品談判、用藥保障制度,根據不同患者人數,譬如10萬人、1萬人、1千人、1百人級別,引入量價掛鉤的原則,制定具有差異性的醫保準入價格標準?如此,剛剛起步的罕見病產業就能可持續地發展,更多的創新企業也會加入進來。
患者最渴望的,不過是能夠正常生活。2016年,一款當時國內唯一能治療多發性硬化症的藥物,因銷量不佳而被宣佈將在中國退市,全國多發性硬化症患者面臨救命藥斷供,是上下齊心的誠懇呼籲,才使該藥物回到國內。正常生活的平凡期盼,對於患者而言,並不容易。
因此,完成患者這個平凡的企盼,是政府和產業的初衷。雖有困頓,但這場探索中的每一方,都在努力創造一個健康可持續的用藥保障機制,讓齒輪運轉起來。
2021註定是罕見病產業爆發澎湃活力的一年。
11月初的醫保談判中,7款罕見病用藥最終談成進入醫保,尤其是原價70萬元一針的髓性肌萎縮症藥品諾西那生鈉,以極低的價格入圍,無論對患者還是藥企,這都是中國醫保基金向罕見病藥物敞開的關鍵一步。
回望2014年,上海市醫學會罕見病分會主委李定國在接受《中國經濟週刊》採訪時,曾介紹“目前沒有任何一家中國製藥企業從事罕見病藥物的研發”。如今不到10年,國內罕見病藥物開發已燃起星星之火。
這次新納入的7款罕見病用藥中,有一款乙型血友病的治療藥品人凝血因子Ⅸ。這款國產藥物開發歷時7年、研發費用上億元,進入醫保後價格遠低於進口同類產品。
資本市場也有利好訊息。12月10日,成立於2012年的北海康成製藥有限公司正式在香港聯交所主機板上市,成為中國罕見病第一股。
這一系列變化,與2018年《第一批罕見病目錄》出臺不無關係,更受到近幾年醫保支援的鼓勵。業內認為,罕見病高價藥的納入極大鼓勵了國內罕見病藥物研發,預期醫保還會繼續納入更多罕見病用藥。
此前出於盈利考量,國內藥企在罕見病市場罕有動作。這一次,中國罕見病產業彎道超車的時機到了嗎?
資料來源:民生證券
政策突破口
據商業諮詢公司弗若斯特沙利文預測,中國罕見病藥物市場將由2020年的13億美元急速增至2030年的259億美元(摺合人民幣1665億元),年複合增長率為34.5%,而美國及世界其他國家的同期年複合增長率分別為10.5%及10%。
中國罕見病藥物市場正在迅速擴大,這是2021年發生的新變化。
罕見病患病人數少,藥物研發難度大,回報不確定性更高,這限制了藥企研發積極性。此外,罕見病藥物的高定價導致可及性難以提高,這是企業不得不考慮的問題。
從歐美罕見病藥物開發歷史可見,研發、註冊、支付等各環節均需要政策性支援。《孤兒藥法案》於1983年的出爐即成為美國罕見病藥物提速的助推劑。
回溯國內罕見病產業發展,最大的突破莫過於2018年《第一批罕見病目錄》(下稱《目錄》)的釋出。《目錄》為制定罕見病相關政策提供了重要依據。
雖然《目錄》僅包含了121種罕見病,與國際上公認的7000多種罕見病相比並不全面,但它起碼完成了兩項使命:界定了罕見病的邊界;為國內罕見病產業指引了方向。
《目錄》釋出後,中國相關部門制定印發《罕見病診療指南》並建立全國罕見病診療協作網,建立罕見病病例資訊登記制度。2019年2月,財政部、海關總署、稅務總局和國家藥監局聯合釋出《關於罕見病藥品增值稅政策的通知》,對首批21個罕見病藥品按簡易辦法依照3%徵收率計算繳納增值稅。
談及《第一批國家版罕見病目錄》的出臺,琅鈺集團副總裁李楊陽表示:“其實大家很早就關注到罕見病領域,政策不太明朗的時候,確實也不知道怎麼著手去做。《目錄》的作用和意義還是很大的,起碼給了從業者方向和信心。”
只有在《目錄》出臺後,這一系列政策才有了落地的依據,相關藥物開發也才有了方向。
從歷年醫保目錄收錄罕見病用藥資料可以看出趨勢所在:
2009年版醫保目錄包含22個罕見病用藥,覆蓋13個病種的罕見病;
2017年版醫保目錄包含30個病種的罕見病用藥,覆蓋15個罕見病;
2019年版醫保目錄包含39罕見病用藥,覆蓋19個病種的罕見病;
2020年版醫保目錄包含45罕見病用藥,覆蓋22個病種的罕見病;
2021年12月,已有40餘種被納入了國家醫保目錄,涉及25種疾病。
資料來源:中國醫保藥品管理改革進展與成效藍皮書,公開資料
2021年醫保談判中,“靈魂砍價”被演繹成了“對哭砍價”,痛點就在於:國內沒有相應的藥物,進口罕見病藥的價格就很難降下來。
據《中國罕見病高值藥物醫療保障研究報告》,截至2020年10月1日,有14種罕見病的國內上市的16種治療藥物未被納入國家醫保目錄。其中有5種藥物尚未有仿製藥,年治療花費皆超過百萬元且需要患者終身維持用藥。
2021版醫保目錄納入的7 款罕見病用藥中,兩款就是這樣的“天價藥”,包括渤健的諾西那生鈉注射液和武田的阿加糖酶α 注射用濃溶液。
客觀的說,如果不是2020年那一場“70萬天價藥”的輿論風暴,諾西那生鈉很難坐到談判桌前,更不會開出超低價。
和全球原研藥行業一樣,只有競品出現,才能逼迫原創新藥降價爭奪市場。這就是中國為什麼要有自己的罕見病藥物的根本原因。
環境成熟了
中國的罕見病研發起步並不算晚。
1991年,中國開展了針對B型血友病的基因治療臨床試驗。1997年,出版了《基因治療》的彭朝暉回國創業,創立了國內第一家基因治療專業公司:深圳賽百諾基因技術有限公司;2003年,賽百諾旗下的“今又生”獲批上市。
這是國內獲批上市的第一款、同時也是世界上的第一款基因治療藥物。可以說,基因治療這股熱風,中國並沒有錯過。
但是,沒有錯過不等於能夠把握。2000年初,國內醫藥行業以大宗原料藥、仿製藥和中成藥為主,“今又生”鶴立雞群的同時,面臨渠道、定價等方面的懵懂。同時,當時國內藥監體系並未與國際接軌,國際上對”今又生“認可度不高。
屋漏偏逢連陰雨,加上同期國際上出現了一例因接受基因治療而死亡的患者,基因治療行業整體蒙灰,國內基因治療的發展走向停滯。
回望“今又生”從輝煌走向平庸,研究基因治療的ASC Therapeutics創始人、董事長姜儒鴻表示:這本質上反映了當時國內創新藥商業環境的不成熟。
《目錄》釋出帶來的信心推動了罕見病業務的繁榮,以及相關產品的接連上市。
首先是罕見病檢測。華大基因,貝瑞基因、明碼生物等公司紛紛佈局罕見病檢測。鑑於80%的罕見病為遺傳性疾病,測序技術可以說是為罕見病而生。隨著測序成本的不斷下降,個體化的罕見病檢測成為可能。以華大基因為例,2007年第一個中國人的基因組測序耗資300萬美元,到2015年這個成本降到了600美元。
北京錦籃基因科技有限公司的成立亦是順勢而為。該公司主要針對神經肌肉病、遺傳代謝性疾病、溶酶體貯積症等多種嚴重威脅人類生命的罕見病開發基因藥物。企查查顯示,公司成立於2018年6月8日,而《第一批罕見病目錄》於當年5月11日正式釋出。2021年2月,錦籃基因宣佈完成近億元的天使輪融資。
再來看北海康成。2020年9月,北海康成宣佈,治療黏多糖貯積症Ⅱ型藥物Hunterase獲得中國國家藥品監督管理局上市批准。
迄今,成立10年的北海康成有了13種藥物組成的產品管線,其中3種已上市(其中3款均為授權引進)、4個處於臨床階段、1個處於臨床前階段,還有兩個臨床前的候選藥物、3個基因治療專案處於先導識別階段。這些產品主要針對較為常見的罕見病和罕見腫瘤適應症。
2021年上半年,北海康成營業收入達到1219萬元,已經超過2020年全年。
產業鏈向好
政策指引加上融資環境友好,罕見病產業鏈條也正在逐步走向完善,最新的基因技術也加入到罕見病的治療中來。
以基因治療領域為例。截至2020年2月,中國開展的基因治療臨床試驗數量為1041項,位列全球第二;除臨床研發外,復星凱特和藥明巨諾兩款CAR-T產品的獲批上市,也進一步激發初創企業對於基因治療的熱情。
信念醫藥聯合創始人、董事長兼首席科學家肖嘯表示:“目前基因治療產品的臨床申報等流程審批上時間縮短了不少,國家對遺傳類疾病的重大專項研究投入也在增多,這都堅定了基因治療行業從業者的信心。”
基因治療火熱,帶動了後續鏈條的逐步完善。國內CXO從業者藥明生基、金斯瑞蓬勃生物、博騰生物、和元生物等均已開始佈局基因治療的CDMO服務。其中,12月7日,金斯瑞蓬勃生物宣佈其在江蘇鎮江佔地6400平方米的GMP生產車間正式投產。
業內人士對於基因治療產業的興起也抱有積極態度:雖然國內目前針對AAV技術的CDMO支援服務多處在臨床前或少數早期臨床試驗,距離後續的商業化還有一段路程,但整體勢頭向好。只要創新環境在,技術升級就不是問題。
除了各技術路線上的產業閉環正在形成外,面對整個罕見病的支援鏈條也在逐步完善。除了基因檢測服務已在國內得到重視,幫助罕見病患者健康管理平臺也越來愈多,如子昂健康、京東健康。
網際網路醫療讓罕見病藥物有了另一個終端出口,網上覆診、線下配送,移動互聯場景下消費者熟悉的網際網路醫療模式,最適合罕見病藥物的推廣。但罕見病患者人數少且分散,物流要求高,這個市場只有具備規模優勢的網際網路醫療頭部企業才能有效服務。
喜憂交加
罕見病領域的藍海,也越來越被市場所看到,尤其是人口基數大的中國市場。
武田中國企業事務與患者服務部負責人張敏女士表示:未來的新技術突破很可能會發生在罕見病領域。
從《第一批國家版罕見病目錄》的釋出,到醫保目錄納入罕見病用藥,可以看出:中國罕見病市場正在崛起。在罕見病領域,中國市場有望實現從追趕到齊頭並進甚至引領世界。
眼下,橫亙在罕見病市場面前的最大問題便是支付難題。2020年,中國居民人均可支配收入為32189元。2021年12月醫保談判中,諾西那生鈉注射液以“地板價”進入醫保目錄,即使考慮醫保報銷因素,家庭負擔也不低。
而且,該事件振奮罕見病產業之餘也帶來了一些思考,那就是:單純憑藉藥企讓利,能否保證罕見病產業鏈條的持續運轉?
對此,業內多家企業均表示:政府確實看到了罕見病市場,這是件好事,不過中國仍需要探索出符合自身國情的多元化支付體系,才能刺激企業創新,讓更多患者用上藥。
在歐美國家,罕見病患者的支付難題主要依賴於商保來解決。以美國為例,由於商保體系發達,美國居民的商保率保持在70%以上,加上政府提供的公共醫療保險,患者用藥的實際承擔費用並不算高。
1983年《孤兒藥法案》正是在這一保險基礎上,才給予製藥企業定價自由權。而且美國政府要求,保險公司不能拒保罕見病患者。
美國罕見病藥物市場可以實現製藥公司、保險公司、患者同步受益,該模式能夠實行的前提是:具有真實準確的罕見病單病種流調資料。因為保險公司需要對賠付和獲益進行精算,需要有流行病學資料。
中國地域遼闊,人口基數大,醫療水平參差不齊,單病種流調資料很難完整呈現,尤其是在發病率極低的罕見病領域。這項工作需要醫療部門有長期、緊密的跟蹤,並非一朝一夕能夠完成。
資料來源:中國醫保藥品管理改革進展與成效藍皮書
期待支付多元
目前格局下,最能符合各方訴求的,就是推動真實有效的多元支付方案形成。
其中最顯而易見的便是網際網路醫療的力量。新冠疫情影響下,網際網路醫療迅速全面開花。據2021年6月30日天眼查資料,國內目前存有9700家網際網路醫療相關企業,其中7成企業成立於1年內。
從商業保險和醫藥出發的鎂信健康,溝通社會上多種資源,幫助罕見病患者提供支付解決方案;以醫藥供應鏈服務和網際網路醫療服務能力為優勢的京東健康,透過建立“罕見病關愛中心”和成立罕見病關愛基金,並聯合品牌商家共同發起公益捐贈服務模式“愛心東東”,為更多有困難的患者減輕支付壓力、提供一站式服務……
除了網際網路醫療外,地方醫保、惠民保及社會組織基金的發展和活躍,也為患者的支付困境帶來新希望。以惠民保為例,目前已有多地對罕見病提供了支付保障措施。雖然目前惠民保在保障範圍和理賠門檻上仍有進步空間,但也需要看到它為罕見病患者的支付難題提供了新的解題思路。
“從創新藥本質出發,藥企以藥物的有效性為擔保,與醫保部門合作,按照患者的疾病程序進行分期付款,也不失為一種好辦法。”有藥企坦言。
總的來說,目前國家主導的醫保支付體系雖然能量強大,但需要完成“保基本”的職能,對罕見病藥物的支援力度不會太大。沒有納入醫保的罕見病藥物,完全推給社會,商保又很難承接,只能靠慈善、公益來補充。
建立一套醫保、商保、慈善共同參與的多元化支付體系,而不是“非此即彼”的支付方式,這才是今後保證中國罕見病藥物開發事業最有力的推動因素。
2021年9月,國家醫療保障局在對十三屆全國人大四次會議第3983號建議的答覆中稱,將一方面強化醫療救助兜底功能,另一方面加強與慈善組織的合作,引導慈善組織、慈善力量在罕見病等特定領域發揮作用。在此基礎上,進一步健全多層次醫保體系,大力推動發展商業健康保險,充分發揮商業保險風險管理和保障功能的作用,多層次提高參保患者醫療保障水平。
除了希望完善罕見病藥品的支付流程,對於即將到來的《目錄》能更新,業內給出的意見大都一致:希望儘快出新《目錄》,希望納入更多的罕見病種。
此外,還有業內聲音稱,對於國外有藥的產品的引進,也要考慮完善對其藥品的產權保護。
本頭條號有很多內容只對粉絲開放,如有需要,請加關注[作揖]
版權宣告:我們注重公益性分享,文章、圖片來自網路,版權歸原作者,如有異議,請告知小編,我們會及時刪除。