系統性紅斑狼瘡(SLE)是一種高度異質性疾病,伴有全身慢性炎症和自身免疫反應,SLE相關自身抗體和高血清干擾素α(IFN-α)是SLE中兩種重要的遺傳表型。SLE被認為是“I型干擾素病”的原型,大部分患者的血液中存在IFN刺激基因(ISG)轉錄特徵。此外,全基因組關聯分析(GWAS)表明編碼參與核酸降解和感測以及I型干擾素訊號通路的分子的基因與SLE易感性密切相關【1-3】。
與SLE發病機制相關的因素很多,多基因易感性和複雜的表觀遺傳調控是誘導其發生的重要因素,而線粒體功能障礙引起的氧化應激也被發現在其中發揮著關鍵作用。研究發現,源於線粒體功能障礙的氧化和亞硝化應激可能成為SLE患者細胞凋亡/壞死增加、非高血糖代謝綜合徵、多種新抗原形成和免疫失調的病理生物訊號【4】。SLE的中性粒細胞逐出氧化的線粒體DNA(ox-mtDNA)是一種有效的干擾刺激,而琥珀酸驅動的線粒體活性氧(mtROS)的積累是SLE兒童中獨特的CD4+ T細胞輔助亞群的一個特徵。鑑於SLE是一種幾乎涉及所有器官的高度異質性的系統性自身免疫性疾病,那麼線粒體功能障礙是否會影響SLE患者的其他細胞系而發揮著其他我們尚未了解的作用呢?答案是肯定的。
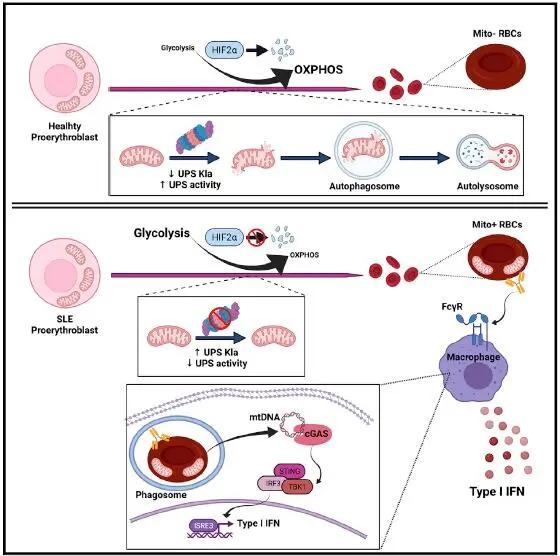
近日,來自美國威爾康乃爾醫學院的Virginia Pascual團隊在Cell上線上發表文章:Erythroid mitochondrial retention triggers myeloid-dependent type I interferon in human SLE,利用小分子抑制劑和泛素-蛋白酶體系統(UPS)功能基因缺陷患者的細胞,證明了在人類紅系細胞成熟過程中,缺氧誘導因子(HIF)介導的代謝開關可調節線粒體自噬上游的UPS的啟用,發現在SLE患者中,該通路的缺陷阻止了UPS的啟用,並隨後阻斷了線粒體自噬,從而導致干擾性含有線粒體的紅細胞(Mito+ RBC)的積聚。由此證實在SLE中存在著程式化線粒體去除(哺乳動物紅細胞生成的標誌)缺陷,並且與SLE疾病活動性相關。
在晶狀體上皮細胞和紅系譜系的正常發育過程中都會發生程式化線粒體去除。紅系細胞的分化是在去核和網織紅細胞最終成熟為紅細胞(RBC,線粒體完全去除)之前,透過形態不同的有核前體階段進化而來的。然而,本文研究人員卻驚訝地發現,在SLE患者中有多達37.2%的成熟RBC含有線粒體(這一類RBC被稱為Mito+ RBC),分析顯示這些迴圈中的Mito+ RBC的比例與貧血、種族或治療均無關,但是與透過SLE疾病活動性指數(SLEDAI)測量的疾病活動性密切相關。那麼Mito+ RBC是怎麼產生的呢?
要解決這個問題,首先要了解人類紅系分化末期過程中線粒體去除的機制,因此研究人員以外周血單核細胞(PBMC)起始產生原紅細胞,從而再現人類紅細胞成熟過程。研究人員首先監測了人原紅細胞成熟的最後階段不同時間點的線粒體蛋白水平,意外的發現線粒體蛋白並不是同步降解的,而是按照降解速率分為兩大類:一類蛋白質在分化過程中被迅速去除(快速去除的線粒體蛋白質[RRMP]),另一類則直到最後的時間點(緩慢去除的線粒體蛋白質[SRMP])才受到影響。由此提示人類紅細胞生成過程中調節線粒體降解的機制不止線粒體自噬。有證據表明,在透過線粒體自噬去除殘留的線粒體之前,被選定的線粒體蛋白質會被UPS迅速降解。隨後的實驗結果發現,RRMP以UPS依賴的自噬非依賴性方式降解,而SRMP則透過線粒體自噬被清除。與此一致的是,UPS活性在原紅細胞分化的早期階段達到最大值,而自噬通量僅在後期增加。同時,研究人員證明所選線粒體蛋白的蛋白酶體降解對於觸發人原紅細胞的線粒體自噬至關重要,而15-脂氧合酶(ALOX15)在細胞質UPS接近選定蛋白質方面發揮著關鍵作用,是完成線粒體自噬的必要步驟。
進一步地研究發現,在紅系分化末期能量需求的增加需要從糖酵解向氧化磷酸化(OXPHOS)轉換,而這受到HIF-2α降解的調節。在原紅細胞中,UPS活性受到代謝調控,乳酸水平可透過調節UPS賴氨酸乳酸化(Kla)水平來調節代謝開關介導的UPS啟用。由此證實HIF-2α介導的代謝重程式設計是人類紅細胞生成過程中UPS啟用的上游。而對來自SLE患者的PBMC的RBC進行分析發現可以將其分為兩類,一類是原紅細胞去除了線粒體(R),一類則沒有去除(NR)。其中NR表型與高SLEDAI評分相關,並且這些患者的原紅細胞在分化時的UPS活性未能增加,與R原紅細胞相比,NR的基因表達和生物能譜均顯示分化後24小時糖酵解到OXHPOS的轉化率降低,而這都源於NR原紅細胞分化過程中HIF-2α的降解缺陷。
最後,研究人員探索了Mito+ RBC對於SLE患者的影響。研究結果發現Mito+ RBC來源的mtDNA是巨噬細胞以cGAS依賴的方式反式產生Ⅰ型IFN的有效刺激,而同時攜帶Mito+ RBC和調理抗體的SLE患者顯示出最高水平的血液ISG訊號——SLE的一個顯著特徵。
綜上所述,本文證實了在SLE患者中有那麼一部分群體的HIF調節的代謝和蛋白酶體途徑存在缺陷,從而導致含有線粒體的紅細胞的聚集,當這些細胞被巨噬細胞吞噬時,即可啟用cGAS/STING依賴性炎症。
原文連結:
https://doi.org/10.1016/j.cell.2021.07.021
製版人:十一
參考文獻
1. George, N.G., Maria, I.Z., Vassilis, M.V., et al. (2018). The genetics and molecular pathogenesis of systemic lupus erythematosus (SLE) in populations of different ancestry. Gene. 20;668:59-72.
2. Banchereau, R., Cepika, A.M., Banchereau, J., and Pascual, V. (2017). Understanding Human Autoimmunity and Autoinflammation Through Transcriptomics. Annu. Rev. Immunol. 35, 337–370.
3. Langefeld, C.D., Ainsworth, H.C., Cunninghame Graham, et al. (2017). Transancestral mapping and genetic load in systemic lupus erythematosus. Nat. Commun. 8, 16021.
4. Chang, Y.T., Song, C.H., Cheng, S.L., et al. (2019). Cross-Talk between Mitochondrial Dysfunction-Provoked Oxidative Stress and Aberrant Noncoding RNA Expression in the Pathogenesis and Pathophysiology of SLE. Int J Mol Sci. 19;20(20):5183.