身體傷害和神經退行性疾病往往給中樞神經系統(CNS)帶來不可逆轉的損傷並且導致功能喪失。在哺乳動物中,這種功能喪失的原因是由於成年的CNS神經元無法再生。近年來,科學家們在發現導致再生失敗的分子和細胞機制方面取得了顯著的進步,然而在促進神經再生方面,所有策略尚不能帶來完全或者接近正常的神經通路恢復。近日,頂尖科學期刊《細胞》上發表的一篇綜述對CNS再生的當前理解進行了盤點,並且指出了未來臨床研究的潛在方向。
今天的這篇文章裡,藥明康德內容團隊將與讀者分享這一綜述中的部分精彩內容,點選文末“閱讀全文/Read more”,即可訪問綜述網址。
中樞神經系統和外周神經系統再生潛力的區別
提到再生,我們可能都聽說過有些爬行動物和兩棲動物驚人的再生潛力,比如蜥蜴和蠑螈能夠再生切除的肢體或者尾巴,並且完全恢復正常的運動功能。在哺乳動物中,外周神經系統(PNS)的神經元雖然沒有像爬行動物和兩棲動物那麼強的再生能力,但是也具有一定程度的再生潛力。以往的研究指出,即使在成年哺乳動物中,脊髓神經元支配肌肉的外周神經在受到損傷後可以再生並且重新與肌肉產生連線。然而,CNS的神經元則沒有這種再生能力。它們之間有什麼區別?
一個重要的區別是在哺乳動物中,PNS和CNS對損傷的反應大不相同。在PNS損傷發生後,生成外周髓鞘的施萬細胞(Schwann Cells)會產生積極清除損傷產生的破損組織和碎片的作用。此外,PNS神經元損傷後激發的重程式設計也會幫助神經元的再生。在PNS神經元中,mTOR和STAT3等訊號通路的啟用均增強外周神經的再生。
CNS神經元的再生也受到轉錄程式和促生長訊號通路等細胞內在因素,以及受損的軸突在環境中遇到的分子和細胞等外在因素的影響。下面,我們來看一看調節CNS神經元再生的內在和外在因素。
調節CNS再生的內在因素
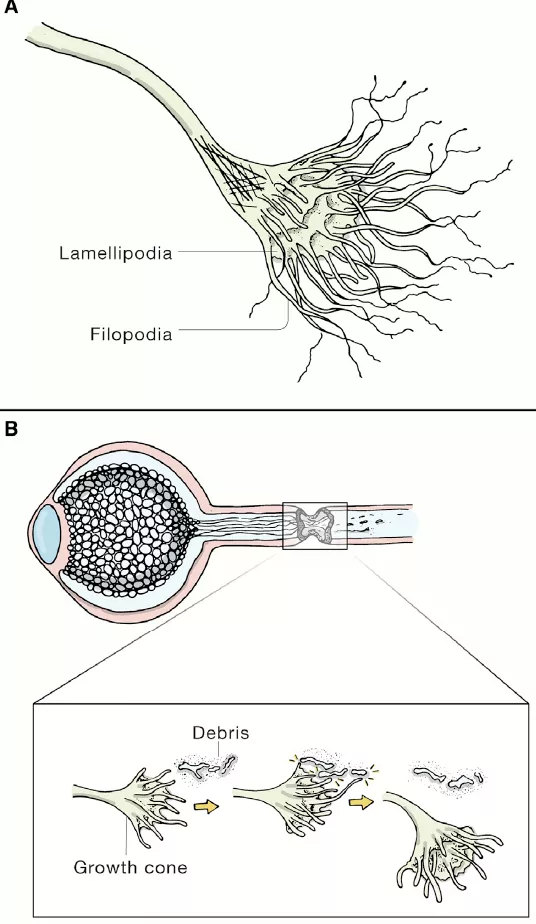
受損傷的CNS神經元再生的第一步是生成一個生長錐(growth cone,下圖A)。再生神經元的生長錐有點像一個手掌,像指頭一樣的突起是絲足,它們對生長錐感知周圍的環境,並且向目標前進至關重要(下圖B)。
圖片來源:參考資料[1]
在中樞神經系統中,如果將背根神經節(DRG)細胞投射向CNS的分支切斷,大約三分之一受損的軸突會在兩天內生成生長錐並開始再生。這代表著CNS軸突的最初再生反應(雖然它的持續時間不長)。而大部分CNS軸突在遇到環境中的蛋白聚糖後,形成了名為收縮球(retraction bulb)的結構,這一結構不會繼續生長。
研究顯示,生長錐中微管結構的不穩定和紊亂會導致生長錐變成收縮球,而使用一款FDA批准的藥物epothilone B能夠逆轉這一效果,特異性敲除名為RhoA的GTP酶也能起到同樣的作用。
成熟CNS神經元會下調在發育過程中的多個轉錄程式,因而限制了它們的再生潛力。比如,調節mTOR的訊號通路在新生CNS神經元中增強細胞的生存、生長、代謝和蛋白合成。然而在成年CNS神經元中,mTOR的負面調節因子PTEN的活性顯著降低mTOR訊號水平。已有實驗顯示,調節mTOR訊號通路是一種促進軸突生長和細胞生存的有力方式,在視覺和脊柱CNS損傷模型中都獲得了可喜的結果。
mTOR訊號通路之外,調節Sox11、KLF等轉錄因子的活性也可以啟用促進生長的因素。
調節CNS再生的外在因素
調節CNS再生的主要外在因素來自受損軸突的髓鞘碎片,以及由星狀細胞、成纖維細胞、小膠質細胞、源於血迴圈的免疫細胞和細胞外基質在損傷處生成的膠質瘢痕(glial scar)。中樞神經系統與外周神經系統的重要不同之處在於中樞神經的髓鞘是由少突膠質細胞(oligodendrocyte)生成的。少突膠質細胞在神經受損之後並不會像PNS的施萬細胞一樣吞噬並清除髓鞘碎片。而且在CNS中,小膠質細胞吞噬髓鞘碎片的能力也不如巨噬細胞。這導致髓鞘碎片無法從損傷處清除,給神經再生設立了障礙。
另一個被認為阻礙CNS再生的障礙是在損傷處形成的膠質瘢痕。早期研究顯示膠質瘢痕表達大量抑制神經生長的分子,包括硫痠軟骨素蛋白聚糖(CSPG),訊號素3A和肝配蛋白B等等。然而,並不是所有在膠質瘢痕中發現的分子都對軸突生長產生抑制作用,有些糖胺聚糖支鏈反而能夠促進軸突的生長。對膠質瘢痕中細胞的轉錄組研究發現多種允許神經再生的分子。這些研究綜合起來顯示,膠質瘢痕並不是一個完全抑制性環境,而是由允許神經再生的訊號和抑制神經再生的訊號構成的複雜環境。再生的軸突必須穿越這個複雜環境才能夠達到目的地。
促進CNS再生的策略
作者表示,一些有希望的研究表明,在脊髓損傷之後調節內在和外在因素可以促進軸突再生。比如,增強mTOR活性和神經元的電活動可以促進軸突再生並且穿越受傷部位。透過神經幹細胞移植或者過度表達Oct4、Sox2、和KLF4轉錄因子,可以將成熟的神經元重新程式設計為與發育時期類似的狀態,從而促進軸突的再生和功能的恢復。
▲促進神經再生的策略(圖片來源:參考資料[1])
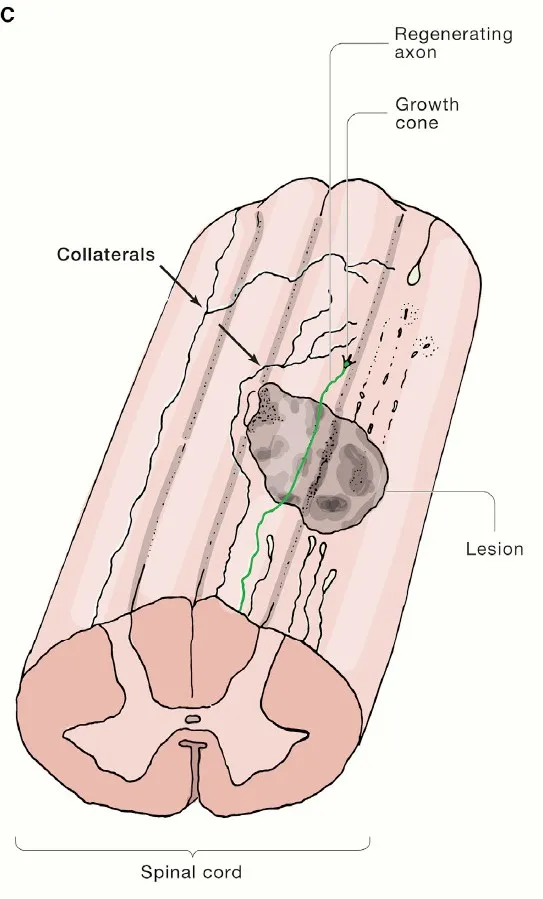
此外,從恢復功能的角度來看,另一種策略是透過生長因子或者導向分子,誘使未受到損傷的神經幹生長旁支(collaterals branch),這些旁支可以繞過受到損傷的部分,與遠端的神經元產生新的突觸連線,從而促進功能的恢復。大多數現實中的神經損傷會保留一部分不受傷害的神經元和軸突,因此,如何保護這些殘留的神經元並且最大化它們恢復功能的潛力是目前急需解決的問題。
已有研究顯示,促進軸突旁支的生長可以在脊髓損傷的動物中促進運動迴路的功能恢復。這一策略的潛在缺陷是持續上調促進生長的訊號可能導致豐富但是不正常的旁支生長,這不見得有利於構建可以恢復功能的神經迴路。
▲脊髓受損後受傷神經的再生(綠色)和未受傷神經的旁支生長(箭頭指示處)(圖片來源:參考資料[1])
結語
作者指出,當考慮這些策略在治療人類患者的潛力時,需要注意的一個問題是上調通常只在發育早期活躍的促生長訊號通路可能有致癌風險。因此,目前的很多研究可以作為模型來理解神經損傷後軸突再生和靶點支配的機制,目標是將這些洞見轉化為更為安全的促再生策略。
比如,結合無致癌效應的軸突生長刺激策略(如鋅元素偶聯)和加快退化神經清除的手段可能在獲得有利臨床結果的同時降低不良副作用的風險。
我們已經在多種不同的動物模型中證明了強力軸突再生的可能性,這給在不遠的未來,在人類患者中實現損傷後的CNS功能恢復帶來了希望。
參考資料:
[1] Varadarajan et al., (2021). Central nervous system regeneration. Cell, https://doi.org/10.1016/j.cell.2021.10.029