CheckMate-649研究證實,納武利尤單抗聯合化療作為晚期或轉移性胃癌、胃食管交界處癌或食管腺癌患者的一線治療,可顯著改善患者無進展生存期(PFS)和總生存期(OS)。ATTRACTION-4是日本、韓國及臺灣地區聯合開展的II-III期研究,對比了在HER2陰性不可切除晚期或複發性胃癌或胃食管交界處癌患者中,納武利尤單抗聯合化療或安慰劑聯合化療作為一線治療時的療效與安全性,該文章近日發表於Lancet Oncology雜誌。
背景
胃癌,是全世界第五大常見癌症,東亞地區的胃癌發病率明顯高於世界其他地區[1]。對於無法切除的晚期或複發性胃或胃食管交界處癌患者,由於消瘦和消化不良,通常患者治療耐受性會下降,因此晚期胃癌的治療較為棘手。
指南顯示,曲妥珠單抗聯合化療已成為HER2陽性晚期胃癌患者的標準一線治療。而對於HER2陰性晚期胃癌患者,既往一線治療標準為基於氟嘧啶和鉑類藥物的化療,2021年報道的CheckMate-649研究證實,與單純化療相比,納武利尤單抗聯合化療可顯著改善患者PFS和OS[2]。據此研究,FDA和NMPA均已批准納武利尤單抗聯合化療用於一線治療晚期或轉移性胃癌、胃食管交界處癌或食管腺癌患者。
在CheckMate-649研究發表之前,日本、韓國及臺灣地區曾聯合開展ATTRACTION-4研究,該研究評估了納武利尤單抗聯合奧沙利鉑為主的化療與安慰劑聯合奧沙利鉑為主的化療作為HER2陰性晚期胃癌患者一線治療的療效與安全性,儘管納武利尤單抗的一線使用已獲批,但該研究的結果依然備受關注。
方法
這是一項隨機、多中心、雙盲、安慰劑對照的II-III期試驗(NCT02746796)。入組標準為年齡≥20歲、既往未經治療(復發前180天之前完成的新輔助化療或輔助化療除外)、HER2陰性、不可切除、至少有一個可測量的病變且美國東部腫瘤協作組(ECOG)體能狀態基線評分為0或1的晚期或複發性胃或胃食管交界處癌患者。患者按照1:1的比例隨機接受每3週一次的納武利尤單抗360 mg靜注聯合化療(納武利尤單抗+化療組)或安慰劑聯合化療(安慰劑+化療組),化療方案為第1天奧沙利鉑130 mg/m2靜注,第1-14天每日兩次S-1 40 mg/m2口服(SOX方案),或第1天奧沙利鉑130 mg/m2靜注,第1-14天每日兩次卡培他濱1000 mg/m2口服(CAPOX方案)。研究主要終點是意向治療人群的無進展生存期(PFS)和總生存期(OS)。研究對所有接受了至少一劑治療的患者進行了安全性評估。
結果
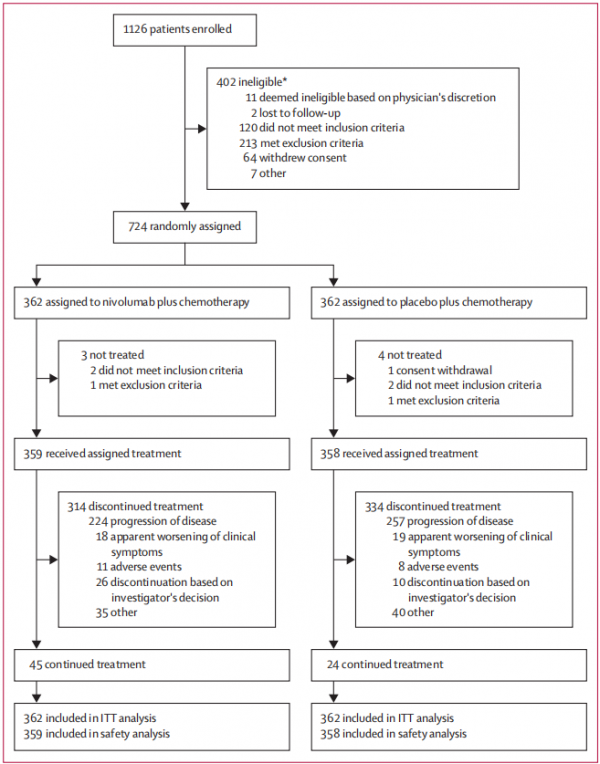
從2017年3月23日至2018年5月10日,研究共納入724名患者:其中362名患者進入納武利尤單抗+化療組,362名患者進入安慰劑+化療組。
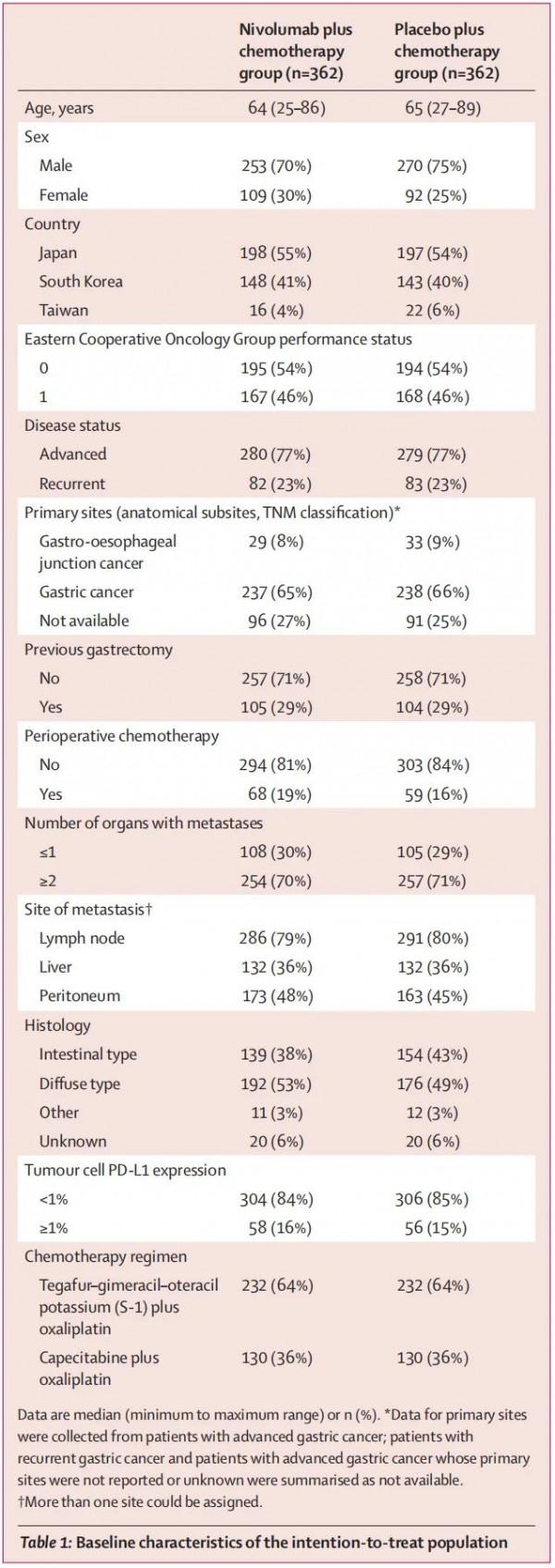
患者基線特徵如表1所示。
表1 患者基線特徵
截至2018年10月31日進行預先指定的中期分析時,患者中位隨訪時間為11.6個月(IQR [四分位距] 8.7-14.1),如圖2所示,納武利尤單抗+化療組的中位PFS為10.45個月(95%CI 8.44-14.75),安慰劑+化療組的中位PFS為8.34個月(95%CI 6.97–9.40)。
截至2020年1月31日進行最終分析時,患者中位隨訪時間為26.6個月(IQR 24·1-29.0),如圖3所示,納武利尤單抗+化療組的中位OS為17.45個月(95%CI 15.67–20.83),安慰劑+化療組為17.15個月(15.18-19.65)。
納武利尤單抗+化療組有98%的患者出現治療相關不良事件(351/359),安慰劑+化療組則為97%(349/358)。最常見的治療相關3-4級不良事件是中性粒細胞減少(20% vs. 16%)、血小板減少(9% vs. 9%)和食慾下降(8% vs. 6%)。納武利尤單抗+化療組中,任意級別的治療相關嚴重不良事件發生率為25%,3-4級治療相關嚴重不良事件發生率為18%;安慰劑+化療組中,任意級別的治療相關嚴重不良事件發生率為14%,3-4級治療相關嚴重不良事件發生率為9%;其中最常見的治療相關嚴重不良事件為食慾下降(5% vs. 3%)。納武利尤單抗+化療組發生3例治療相關死亡,中性粒細胞減少症、肝衰竭和猝死各1例;安慰劑+化療組也發生3例治療[1]相關死亡,敗血症、溶血性貧血和間質性肺病各1例。
結論
對於未經治療、HER2陰性、不可切除的晚期或複發性胃或胃食管交界處癌的亞洲患者,納武利尤單抗聯合基於奧沙利鉑的化療可顯著改善患者PFS,但OS未顯著提高。儘管納武利尤單抗聯合化療的3-4級和治療相關嚴重不良事件發生率更高,但其安全性依然可控,患者的生活質量得以保證。該研究顯示,納武利尤單抗聯合化療可能成為患者一線治療新選擇。
參考文獻
[1] Siegel R L, Miller K D, Fuchs H E, et al. Cancer Statistics, 2021[J]. CA Cancer J Clin, 2021,71(1):7-33.
[2] Janjigian Y Y, Shitara K, Moehler M, et al. First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastro-oesophageal junction, and oesophageal adenocarcinoma (CheckMate 649): a randomised, open-label, phase 3 trial[J]. Lancet, 2021,398(10294):27-40.