環狀RNA (circRNA) 是由pre-mRNA透過反向剪接形成的閉合環狀RNA分子。在生物體內,環狀RNA可發揮miRNA海綿、結合蛋白以及翻譯成短肽等分子功能調控各種生理和病理過程。與線性mRNA相比,環狀RNA獨特的環狀結構使其具有更高的穩定性,在細胞內可以更穩定的存在。因此,環狀RNA更適合作為腫瘤的分子標誌物及治療靶點。然而,目前大部分環狀RNA在腫瘤發生發展中的具體調控功能與分子機制還有待深入研究。 2022年1月24日,中國科學院北京生命科學研究院 趙方慶 團隊在 Advanced Science 期刊發表了題為: circVAMP3 drives CAPRIN1 phase separation and inhibits hepatocellular carcinoma by suppressing c-Myc translation 的研究論文。 該研究報道了 環狀RNA circVAMP3透過促進CAPRIN1蛋白相分離,在細胞內形成應激顆粒 (stress granules) 以阻止c-Myc mRNA的翻譯,進而抑制肝細胞性肝癌 (HCC) 的發生發展。 該工作首次證實了環狀RNA可以透過發揮分子骨架的功能促進相分離形成,從而調控腫瘤的增殖與遷移過程,為惡性腫瘤的研究提供了新的分子標誌物和治療靶點。
首先,研究人員透過對20對肝癌及癌旁樣本的RNA-seq資料進行挖掘,篩選到了在肝癌中表達顯著下調且其母本基因變化不大的環狀RNA——circVAMP3。circVAMP3由VAMP3基因的第3、4外顯子透過反向剪接成環,具有與線性VAMP3基因截然不同的表達模式,並且與患者的預後顯著相關。研究人員利用RNA干擾技術,透過體內外功能實驗證明了circVAMP3具有抑制HCC細胞增殖和遷移的作用 (圖1) 。

圖1. circVAMP3的分子特徵以及對HCC的抑制作用 接下來,他們對circVAMP3調控肝癌發生的機制進行了深入探究。透過對circVAMP3互作分子的篩選發現,circVAMP3可以作為分子骨架與CAPRIN1蛋白的RGG結構域結合,進而招募CAPRIN1-G3BP1複合物,導致蛋白聚集併發生相分離,在細胞中促進應激顆粒的形成。儘管先前的研究表明線性RNA可調控蛋白相分離過程,該研究首次證實了環狀RNA也可透過聚集蛋白促進相分離的發生 (圖2) 。

圖2. circVAMP3促進CAPRIN1蛋白相分離和細胞內應激顆粒形成 隨後,研究人員進一步發現circVAMP3透過抑制c-MYC蛋白的翻譯,進而抑制肝癌細胞的增殖和遷移。透過共定位研究揭示了circVAMP3透過應激顆粒抑制c-Myc翻譯的分子機制 (圖3) 。非常有意思的是,除了在肝臟中,circVAMP3在其他組織中 (如腦、胃、結腸、脾臟、肺、甲狀腺、腎臟等) 也可以廣泛表達,並且其在對應的腫瘤組織中表達量均發生下調。研究人員進一步對不同組織不同腫瘤細胞系對circVAMP3進行干擾實驗,發現均可以抑制腫瘤細胞的增殖和遷移,這提示circVAMP3廣泛參與了不同型別的腫瘤發生發展的普適性調控,以及其可能成為腫瘤研究共性靶標分子的潛力。
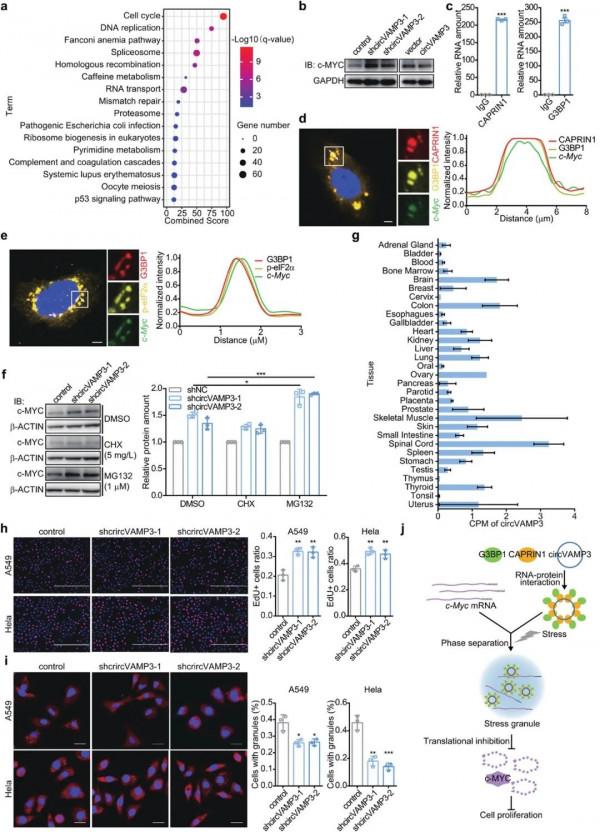
圖3. circVAMP3抑制HCC細胞增殖的分子機制 綜上所述,該研究首次發現了環狀RNA具有促進相分離的生物學功能,並系統闡釋了circVAMP3、c-Myc和應激顆粒互作對HCC發生發展的調控作用,為環狀RNA分子功能研究提供了新角度。該研究揭示了circVAMP3可以作為HCC和其他惡性腫瘤的診斷以及預後判斷的理想靶標分子,為環狀RNA透過相分離調控腫瘤發生發展的機制研究提供了新思路。 該研究由中科院北京生命科學研究院趙方慶研究員團隊完成。博士研究生陳帥、博士後曹曉菲和張金陽為共同第一作者。趙方慶團隊在前期工作中建立了環狀RNA識別、重建、定量和功能挖掘的技術和方法,相關研究發表在Nature Biotechnology (2021)、Nature Communications (2016, 2020)、Genome Biology (2015, 2020)、Briefings in Bioinformatics (2018)、Trends in Genetics (2018)、Trends in Biochemical Sciences (2021)、Genome Medicine (2019)、Cell Reports (2019)和Bioinformatics (2020)。這些研究豐富了我們對環狀RNA的組成及結構的認識,為深入瞭解這一類特殊的RNA分子提供了重要工具和資料支援。
《生物世界》近期推出了“環狀RNA”專欄,每週解讀和介紹環狀RNA的最新研究進展、綜述,以及相關創業公司報道、訪談等。
【來源:中國網醫療頻道】