在少數 HIV 感染者中,在沒有抗逆轉錄病毒治療的情況下,病毒仍處於控制之下。結果表明,在這些人中,整合到宿主基因組中的病毒 DNA 處於深度轉錄抑制狀態。
抗逆轉錄病毒療法 (ART) 徹底改變了我們控制 HIV 的能力。但 ART 不是治癒方法——即使經過數十年的成功治療,HIV 基因組也可以整合到宿主 DNA 中並以無聲的形式隱藏在細胞中1 - 3。ART 必須終生持續,以防止病毒從這些病毒庫中反彈。是否可以透過研究一小部分(小於 0.5%)無需抗逆轉錄病毒療法即可控制病毒複製的 HIV 感染者找到防止這種病毒反彈的方法?在自然中寫作,江等人。4將這些被稱為精英控制者的人的病毒庫與接受抗逆轉錄病毒治療的人進行了比較。他們的研究結果表明,精英控制與一個不太可能重新啟用 HIV 的小水庫有關。
作者首先使用一種複雜的測序技術來比較兩組人數百萬個細胞中的病毒基因組(原病毒)。正如預期的那樣,比較顯示精英控制者的 HIV 基因組複製數少於接受 ART 的人。然而,在控制器中發現的較高比例的前病毒在基因上是完整的——這意味著它們在轉錄時有可能產生傳染性病毒顆粒。
經常在精英控制者中觀察到許多相同的病毒基因組複製。這一觀察證實受感染的細胞具有在控制者中增殖的能力,就像在接受 ART的人中一樣。眾所周知,精英控制者會對感染 HIV 的細胞產生有效的免疫反應,作者發現,在精英控制者中持續存在的前病毒序列預計會產生可以被這種反應靶向的病毒蛋白。
那麼,這些前病毒是如何逃避免疫反應的呢?為了回答這個問題,作者利用最近開發的方法結合相應的前病毒序列來分析病毒整合到宿主基因組中的位點。分析揭示了幾個特徵,表明精英控制者中發現的前病毒比接受 ART 治療的人中的前病毒處於更深的潛伏狀態(休眠)。
首先,精英控制者中的前病毒更有可能整合到基因組的非蛋白質編碼區域中。其次,來自控制者的病毒基因組經常位於稱為著絲粒的染色體結構上的重複 DNA 片段中或被其包圍。宿主基因組被包裝成一種稱為染色質的 DNA-蛋白質複合物——在著絲粒處,這種包裝異常密集,強烈抑制轉錄。第三,精英控制者中的大部分 HIV 基因組被整合到編碼鋅指蛋白家族成員的基因中,眾所周知,在鋅指蛋白家族中,染色質帶有許多與轉錄抑制相關的分子修飾。
作者還對可接近的染色質區域(可能轉錄的區域)進行了分析,結果表明精英控制者 DNA 中的病毒整合位點與接受 ART 治療的個體相比,距離可接近染色質的位點明顯更遠。這一結果強化了這樣一種觀點,即精英控制者的基因組不太可能主動產生病毒轉錄物和蛋白質。事實上,精英控制者中完整的前病毒產生的病毒轉錄本比接受 ART 的人的 HIV 基因組少十倍。
兩種情況可以解釋精英控制者特有的前病毒環境。首先,HIV整合可能優先發生在這些個體基因組的特定區域。或者,隨著時間的推移,可以選擇整合到非編碼或轉錄抑制區域的前病毒,而那些更允許病毒轉錄的前病毒被淘汰。
明確區分這兩種可能性需要研究人員長期跟蹤精英控制者,這不在當前研究的範圍內。然而,當江等人。來自精英控制者和接受體外HIV 抗逆轉錄病毒治療的人的感染細胞,他們發現兩者之間的整合模式沒有顯著差異,這使得第一種情況不太可能發生。第二種模型也很有吸引力,因為在精英控制者中經常觀察到針對 HIV 感染細胞的異常有效的免疫反應。這些反應可能會逐漸消除更可能產生病毒蛋白的含有原病毒的細胞(圖 1)。多年來,這種選擇可能會導致完全由不太可能被重新啟用的前病毒組成的儲存庫。
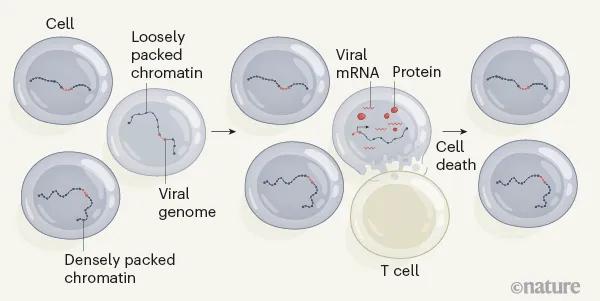
圖 1 | 精英控制者中睡眠 HIV 的選擇。一小部分 HIV 感染者可以在沒有抗逆轉錄病毒治療 (ART) 的情況下控制病毒。江等人。4提供證據表明這些精英控制者中的病毒 DNA 整合到宿主基因組中。一些病毒基因組整合在宿主 DNA 與蛋白質鬆散包裝在稱為染色質的複合物中的位置,這意味著可以發生轉錄。其他病毒 DNA 整合在宿主位點,由於染色質包裝密集,轉錄受到抑制。轉錄病毒的細胞(產生病毒信使 RNA 和蛋白質)被免疫 T 細胞有效地靶向——這種反應只在精英控制者中可見。這些細胞被殺死,因此隨著時間的推移,一小部分具有深潛 HIV 基因組的細胞被進化選擇。
這一想法得到了先前工作的支援表明具有複製能力的病毒池在精英控制器中非常小。此外,Jiang 及其同事研究的一名參與者根本沒有檢測到具有複製能力的 HIV,儘管作者徹底分析了該人的超過 10 億個細胞。很難證明 HIV 是否已從這個人的身體中完全根除,但他們的案例肯定會讓人想起以前關於 HIV 治癒的報道。
精英控制者只代表一小部分艾滋病病毒感染者。儘管如此,Jiang 及其同事的工作對這一人群的其他人有幾個影響。這表明,經過多年的 ART 病毒抑制後,深潛伏的原病毒可能會優先持續存在,特別是在對 HIV 保持免疫反應的個體中。也許多年來持續的免疫壓力會選擇一個小的病毒庫,在那裡 HIV 複製不太可能重新點燃。但是,在 ART 中斷期間,深度睡眠的病毒基因組是否可以重新啟用並導致病毒反彈仍有待確定。
無論哪種方式,這項研究的結果表明,在測量可能導致病毒反彈的持續性 HIV 儲存庫的大小時,應該評估病毒基因組的完整性和啟用潛力。目前用於估計病毒庫大小的測定通常測量完整 HIV 基因組的數量或它們在體外產生 RNA 或蛋白質的能力。姜及其同事的工作表明,將這兩種措施結合起來可能是必要的,因為許多完整的基因組可能不容易被重新啟用。聯合測量可以為研究人員和臨床醫生提供更好的抗逆轉錄病毒治療中斷後病毒反彈的預測指標。
該研究表明,透過選擇一小部分含有難以重新啟用的 HIV 基因組的細胞,持續和長期的細胞免疫壓力可能會隨著時間的推移顯著減少 HIV 儲存庫的大小。反過來,這表明免疫細胞療法——包括基於 CAR T 細胞的療法,目前正在開發用於控制 HIV 病毒庫15——不僅可以控制 ART 中斷期間的病毒反彈,還可以將病毒庫縮小到一個池中深潛伏的前病毒。當然,這是否會導致 HIV 感染的長期緩解仍有待確定。