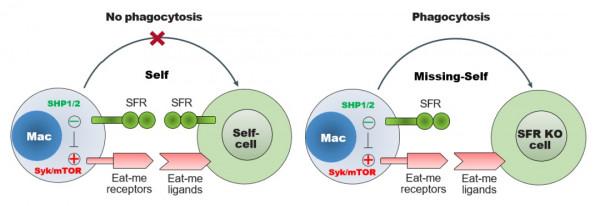
免疫系統既要行使免疫防禦功能,但又要保持自身耐受,即不攻擊自身。具有吞噬功能的巨噬細胞為何不“吃掉”自體健康細胞是重要免疫學問題。目前認為決定巨噬細胞能否發揮吞噬功能主要依賴其表面的活化型“食我”受體和抑制型“別食我”受體。
目前公認的巨噬細胞表面“別吃我”(Don't eat me)受體是SIRPa,它識別廣泛表達的CD47,觸發含有SH2結構域的磷酸酶(SHP)-1和/或SHP-2的訊號,從而抑制巨噬細胞介導的吞噬作用。因此SIRPa/CD47被認為是一種免疫檢查點分子,多種靶向SIRPa/CD47抗體藥物已經進入臨床試驗。儘管如此,SIRPa或CD47缺陷小鼠並沒有或只有輕微的巨噬細胞介導的自身免疫現象,提示機體可能存在其它重要的“別吃我”受體未被發現。
2022年1月21日,清華大學免疫學研究所/醫學院董忠軍課題組在 Science Immunology 期刊發表了題為:SLAMF3 and SLAMF4 are immune checkpoints that constrain macrophage phagocytosis of hematopoietic tumors 研究論文。
該研究首次報道淋巴細胞活化訊號分子(SLAM)家族是一種新型“別吃我”受體,負責抑制巨噬細胞吞噬自身健康血液細胞,當該家族受體缺失時,會引起嚴重的血液細胞移植排斥。

SLAM家族受體由7種同源識別的免疫受體組成,它們通常招募下游SAP家族蛋白傳遞活化訊號,調節多種免疫反應,如NK細胞活化,NK-T細胞發育和抗體產生等。人類SAP基因突變會導致嚴重的免疫缺陷性疾病XLP1。
本研究首次揭示了SLAM家族受體可以透過SHP1/SHP2傳遞SAP家族非依賴的抑制訊號,削弱巨噬細胞表面“吃我”受體訊號,如Syk和mTOR,從而阻止巨噬細胞吞噬自身健康血液細胞(圖1)。SLAM家族受體只表達於血液系統細胞表面,常被用作區分造血幹細胞和其它造血前體細胞的標誌物,該研究首次證明該家族受體類似於CD47,可能是一種新的“自我”分子,特異地抑制巨噬細胞對自身血液的吞噬,維持巨噬細胞耐受。因此,SLAM家族受體可能代表一種血液組織特異性的“別吃我”受體。
該研究具有重要的臨床意義,嗜血細胞綜合徵是一種致死率較高的疾病,臨床上通常出現全血細胞減少,其發病機制與吞噬細胞異常地吞噬正常機體細胞有關。本研究發現人嗜血細胞綜合徵患者血液SLAM家族受體表達顯著降低,提示SLAM家族受體表達量下調可能是噬血細胞綜合徵的發病新機制。
該研究具有潛在的轉化價值,腫瘤細胞高表達“別吃我” 配體可導致腫瘤免疫逃避,譬如腫瘤細胞上調CD47表達可以抑制巨噬細胞的吞噬功能。很多造血系統腫瘤通常也高表達SLAM家族受體,該研究發現阻斷SLAM家族受體可以增加巨噬細胞清除血液系統腫瘤,因此,SLAM家族受體有望成為新的免疫檢查點分子,該研究為腫瘤免疫治療提供新的靶點。
清華大學醫學院李丹博士為該論文第一作者,清華大學免疫所/醫學院董忠軍博士和復旦大學醫學院陳莎莎博士為通訊作者。該工作得到北京地壇醫院曾輝博士、上海交通大學醫學院王靜博士、吉林大學附屬第一醫院楊永廣博士、華中科技大學基礎醫學院武寧博士和暨南大學楊美香博士的大力支援。清華大學實驗動物中心為該課題系列動物模型製備提供了不可或缺的幫助。該研究得到了國家自然科學基金委重點課題、清華大學-北京大學生命聯合中心和清華大學免疫所的經費支援。
董忠軍課題組致力於天然免疫細胞活化和耐受機制研究,特別在NK細胞活化和耐受領域取得了多項進展。該發現揭示了SLAM家族受體的全新功能,為課題組開闢新的研究方向,歡迎有志於該方向的青年才俊加入團隊。