哈嘍,各位guys,大家早上好。大早上的你是不是和小編一樣,在睡眼朦朧,昏昏欲睡呢?那就趕快和小編一起來篇文章提提神吧。今天小編想和大家分享的是一篇來自於nature biotechnology(IF=54.908)的綜述文章,該工作對現有COVID-19相關單細胞組學資料進行整合分析,並彙總現有結論和研究成果,對單細胞免疫分析和COVID-19間關聯進行整合。
自2019年底COVID-19被發現以來,當前全球累計確診新冠肺炎病例已超3.7億例,累計死亡病例超過560萬病例,嚴重危害全球公眾健康,對全球經濟發展造成極大的衝擊和破壞。2020年全球GDP下降4.9%,許多發展中國家的GDP甚至出現兩位數的下降(我國除外)。此外,從長期來看,COVID-19對環境、社會和治理等方面的影響在一段時間內將持續存在。生產率增長的急劇下降,不平等程度的加劇,生物多樣性的崩潰等,都是未來需要優先關注的重點。此外,儘管許多 COVID-19患者表現為無症狀或僅出現輕度,中度症狀,但有些患者仍會發展為嚴重疾病甚至死亡。另外,部分COVID-19痊癒者更是面臨長期的後續健康問題,包括疲倦、呼吸急促、認知問題、嗅味覺失靈、肌肉無力和心悸等。
深入認識瞭解新冠肺炎發病機理,挖掘控制新冠流行的疾病機制對其診療與防控具有重要意義。多項研究表明免疫反應的改變是導致COVID-19患者出現嚴重症狀的關鍵機制之一。因此,更好地瞭解與SARS-CoV-2保護性或病理性免疫相關的免疫細胞亞群和分子,有助於開發COVID-19的疫苗和治療方法。單細胞技術,如流式細胞術、大規模細胞術、單細胞轉錄組學和單細胞多組學分析,為解剖單個細胞間免疫應答的異質性和揭示COVID-19發病機制的分子機制提供很大希望,在探究病毒感染及傳播途徑、加速臨床中和抗體篩選等諸多方面助力新冠肺炎的防控。已經報道的單細胞免疫圖譜研究已經確定與COVID-19疾病嚴重程度相關的固有和適應性免疫細胞亞群,以及與COVID-19疫苗和治療方法開發潛在相關的免疫因子和免疫通路。然而,現階段還沒有較為綜合的COVID-19相關單細胞組學分析資料庫。為促進對SARS-CoV-2感染免疫學的整合研究和meta分析,研究者對21個已釋出的單細胞測序資料集(超過320萬個細胞)進行整合概況,提供標準化、可下載版本的資料,並構建一個可用於資料探索的互動式視覺化網站,有助於幫助新冠的診療與防控。
廢話不多說,快來和小編一起開啟今天的學習旅程吧。
SARS-CoV-2感染的單細胞免疫學
1. 單細胞技術和相關資料集
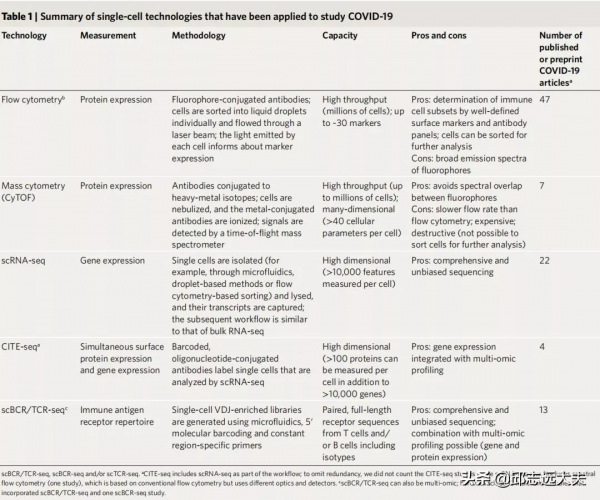
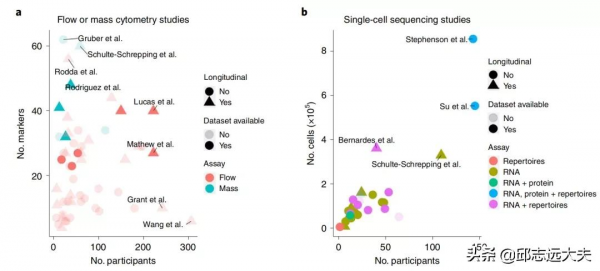
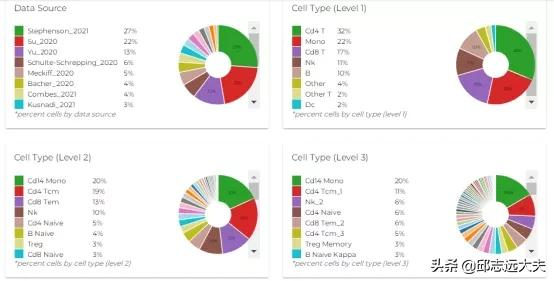
迄今為止在COVID-19研究中使用的單細胞技術,如流式細胞術、大規模細胞術、單細胞轉錄組學等,其中包括62篇已發表的文章和兩篇預印本文章對COVID-19背景下應用一項或多項單細胞技術的研究(表1)。本研究包括多個單細胞測序資料集,其研究的樣本量和維度如圖1所示。流式細胞術是最常用的單細胞技術,但scRNA-seq和單細胞多組學分析也得到更多的使用。流式或大規模細胞術對多達300個個體和多達62個標記物的一個或多個面板的資料進行研究;54個數據集中有25個包含縱向資料(圖1a)。大多數單細胞測序研究分析來自少於150個人的50,000個細胞;其中只有少數包含縱向資料(圖1b)研究者對64篇文章中透過單細胞技術獲得的關鍵結論進行簡要總結,包括新冠與先天免疫細胞、B細胞和T細胞之間的關係,以及單細胞資料與免疫保護之間的相關性進行總結。
表1. 單細胞技術在新冠肺炎研究中的應用
圖1. 使用一項或多項單細胞技術發表的64篇COVID-19相關文章的特徵展示
(2020年3月至2021年3月)
2. 先天免疫反應
大多數基於流式細胞術和大規模細胞術的COVID-19患者外周血單核細胞(PBMCs)分析稱,與健康者相比,迴圈嗜鹼性粒細胞單核細胞、樹突狀細胞(dc)和自然殺傷細胞(NK)的丰度降低,重症COVID-19患者的減少比輕度COVID-19患者的減少更多。相反,與健康獻血者相比,COVID-19患者的迴圈中性粒細胞、嗜酸性粒細胞和單核細胞髓源性抑制細胞的數量增加,COVID-19重症患者的數量比COVID-19輕症患者的數量增加更多。中性粒細胞與淋巴細胞的比值也被報道與重症COVID-19相關。
NK細胞:高維流式細胞術使免疫細胞亞群的深入表徵成為可能。一份關於NK細胞的研究顯示,與健康對照組相比,COVID-19患者的迴圈NK細胞較少,但高度啟用和增殖的NK細胞更多。重症COVID-19與迴圈適應性NK細胞水平的增加有關,表明適應性和活化的NK細胞在COVID-19發病機制中起作用。scRNA-seq資料分析進一步表明在COVID-19中,NK細胞高度啟用。
中性粒細胞:重症COVID-19中存在嗜中性粒細胞胞外陷阱。透過scRNA-seq和中性粒細胞顆粒相關基因的特徵性表達以及典型中性粒細胞標誌物的表達缺陷,研究者發現一個發展中的中性粒細胞亞群,該亞群在急性呼吸窘迫綜合徵患者中特異性增加。另一項以scRNA-seq、高維流式細胞術和大規模細胞術為基礎的研究報告稱,重症COVID-19與迴圈中未成熟中性粒細胞大量增加以及中性粒細胞簇的出現有關,中性粒細胞簇的特徵是S100A8和S100A9等基因的上調。
樹突細胞(DCs):一份包含較大樣本量(52名COVID-19患者,62名健康對照患者)的單細胞資料表明,COVID-19患者血漿細胞樣DCs (pDCs)數量減少,這些pDCs中mTOR蛋白表達減少,提示COVID-19患者血漿細胞樣DCs可能存在干擾素(IFN)-α訊號缺失。
單核細胞:在另一項樣本量也相對較大的資料中(53名COVID-19患者、8名流感樣疾病患者和48名健康對照組),研究人員使用單細胞轉錄組(scRNA-seq)和蛋白質組(CyTOF)分析測試不同的先天免疫反應是否與COVID-19的臨床進展相關。研究顯示,與健康對照組相比,輕度COVID-19患者炎症性HLA-DR-high-CD11c-high-CD14 +單核細胞水平升高。相反,重症COVID-19患者不僅可以透過HLA-DR低表達的單核細胞群(提示單核細胞功能異常)和抗炎巨噬細胞功能相關基因表達增強來區分,還可以透過大量不成熟中性粒細胞表達免疫抑制或功能障礙標誌物來區分。這些發現確定單核細胞反應的功能失調以及骨髓生成的異常是COVID-19進展的潛在重要過程。
透過單細胞技術進行的免疫細胞表型分析,對重症COVID-19與SARS-CoV-2感染相關的多系統炎症綜合徵(MIS-C)中可能失調的免疫途徑有更深入的瞭解。這些瞭解反過來可以針對具有治療潛力的免疫因素,為目前和未來的COVID-19抗炎治療策略的發展提供資訊。已有證據表明這種抗炎治療策略可能有效。此外,流式細胞術、大規模細胞術和scRNA-seq檢測均顯示,在重症COVID-19患者以及與SARS-CoV-2感染相關的MIS-C兒童中,單核細胞HLA-DR和CD86表達降低意味著抗原向T細胞遞呈過程可能受損。單核細胞HLA-DR的下調可能是由白細胞介素(IL)-6驅動的,在重症COVID-19患者和MIS-C兒童患者中,由於IL -6升高導致的HLA-DR表達降低,可以透過Tocilizumab(一種針對IL-6受體(IL-6R)並阻斷IL-6訊號的人源化免疫球蛋白(Ig)G1κ單克隆抗體)部分恢復。
Tocilizumab在預防中度COVID-19患者疾病進展,插管或死亡方面沒有療效;然而,後一項研究在療效比較中有很大的置信區間,另一項報告表明,Tocilizumab在降低通氣需求和死亡率方面有潛在益處。因此,IL-6R阻斷劑是否能使中度或重度COVID-19患者受益的問題仍然懸而未決。其他趨化因子受體阻斷劑也正在進行臨床試驗。基於COVID-19危重或非危重患者鼻咽樣本的scRNA-seq測序,COVID-19中度或危重患者的鼻咽和支氣管樣本的scRNA-seq資料分析表明趨化因子受體CCR1也被識別為潛在的治療靶點。
巨噬細胞:對氣道和肺泡細胞的多項單細胞研究揭示巨噬細胞在COVID-19中的作用,特別是巨噬細胞反應失調可能導致病理性炎症。危重型COVID-19患者表現為上皮細胞和免疫細胞之間配體受體相互作用增加,非resident巨噬細胞中促炎趨化因子和細胞因子基因上調,中性粒細胞、巨噬細胞和CD8+ T細胞中CCR1上調。以上發現表明,肺部免疫細胞招募週期(分化為炎性巨噬細胞的單核細胞,進一步招募和啟用更多的免疫細胞)對重症COVID-19中觀察到的上皮損傷的影響。對BALF細胞的scRNA-seq分析顯示,支氣管肺泡巨噬細胞的比例以及炎症細胞因子和趨化因子受體的水平與疾病的嚴重程度呈正相關。重症COVID-19的巨噬細胞還表現為FCN1和SPP1的高表達,提示肺泡巨噬細胞可能驅動重症COVID-19患者的區域性炎症反應。最後,SARS-CoV-2感染引起的肺炎患者BALF細胞的流式細胞術和scRNA-seq資料顯示,肺泡腔記憶體在高水平的單核細胞以及CD4+和CD8+ T細胞。scRNA-seq在SARS-CoV-2感染引起的肺炎患者的T細胞中發現多個與組織駐留的肺泡巨噬細胞和單核細胞來源的肺泡巨噬細胞對應的簇,以及IFNG的表達。透過流式細胞術分類的肺泡巨噬細胞批次測序識別IFN反應特徵,並在肺泡巨噬細胞中發現SARS-CoV-2 RNA,表明SARS-CoV-2可以在肺泡巨噬細胞中複製,這支援嚴重COVID-19時啟用的T細胞釋放IFN-γ的假說。反過來,這種IFN-γ驅動肺泡巨噬細胞中的IFN反應,導致單核細胞來源的肺泡巨噬細胞的招募,完成炎症訊號迴圈。
另一項來自於四個健康的捐贈者,5名流感感染患者和名8 COVID-19患者PBMCs的RNA-seq分析表明,基於IFN-I相關轉錄特徵和相關炎性轉錄特徵可以區分重症患者的單核細胞。這一發現表明IFN-I反應有助於增加嚴重COVID-19的有害炎症的假設。
3. B細胞反應
中和抗體(nAbs)在預防SARS-CoV-2感染和COVID-19疾病中有著重要的作用,因此,人們對識別針對SARS-CoV-2的有效nAbs產生濃厚的興趣。由於B細胞表現出廣泛多變(V)、多樣性(D)和連線(J)基因(VDJ)重組以及體細胞過度突變特徵,因此這種分析需要單細胞方法完成。
免疫球蛋白序列:識別相關抗體序列的一般策略是透過scRNA-seq對COVID-19恢復期個體的抗原特異性記憶B細胞進行排序和加工。單細胞水平的VDJ測序(scVDJ-seq34)已識別出對SARS-CoV-2具有預防或治療效果的nAb,為nAb臨床試驗提供有效幫助。
在一項採用高通量scRNA VDJ-seq的研究中,識別出約9000個RBD結合的B細胞克隆型,產生14個有效的單克隆抗體,其中一個在小鼠模型中被證明可以防止SARS-CoV-2感染。耦合的scRNA-seq資料允許識別原始B細胞和記憶B細胞的子集,並透過過濾出在原始B細胞和耗竭B細胞中富集的克隆型,幫助提高nAb的選擇效率。另一項使用scRNA VDJ-seq的研究也鑑定出19個有效的單克隆抗體,包括RBD結合的和非RBD結合的單克隆抗體,其中一個在倉鼠模型中被證明可以預防SARS-CoV-2。單細胞功能分析與scVDJ-seq的聯合應用,可以識別出對刺突糖蛋白具有不同反應性和與SARS-CoV-2具有交叉反應性的五類主要單克隆抗體。對來自穩定的COVID-19患者(住院並最終出院)和進展的COVID-19患者(在重症監護室(ICU)接受治療並最終死亡)的PBMC來源單細胞資料的多維整合,包括scRNA-seq和CITE-seq,B細胞受體(BCR)和T細胞受體(TCR)測序等表明COVID-19中存在複雜的B細胞應答,包括高比例的未突變的Igγ重鏈(IGHG) B細胞克隆,與多個突變的B細胞克隆一起出現,隨著時間的推移,體細胞過度突變水平似乎沒有增加。後者可能是由於記憶B細胞與其他冠狀病毒的交叉響應未能形成。
B細胞特徵:高維流式細胞術已被用於表徵和比較不同嚴重程度的COVID-19患者的B細胞反應。一個由24 marker組成的特徵可用來識別B細胞群體,並評估其啟用狀態,從而可以識別濾泡外B細胞過度啟用與COVID-19疾病嚴重程度之間的相關性。重症患者的RBD靶向SARS-CoV-2單克隆抗體在血清中濃度較高,也引發一個問題,即重症COVID-19患者的這種獨特的B細胞反應是否無效,甚至可能具有致病性。其他研究已經描述體液免疫反應與疾病嚴重程度相關。然而,這些正相關性是否僅僅是因為初始病毒載量的增加,仍然是一個懸而未決的問題。不同研究報告具有直接、反向或無相關性等不同的結果。這一差異可能是由於取樣位置,取樣時間和種群的不同造成的。無論如何,需要進行更多的研究來發現感染個體保護性和非保護性體液反應的細胞和分子決定因素。
趨同抗體群(多個患者共享的vdj高度相似的抗體,通常只構成病毒特異性B細胞應答的一小部分)也已被確定,這表明大多數COVID-19患者對RBD具有趨同的Ig重鏈,這可能是由於接種RBD疫苗導致的。
B細胞表型:在一項研究中,研究人員利用RBD四聚體富集和流式細胞術對罕見的RBD特異性B細胞進行表型分析,對從輕度症狀的COVID-19患者中恢復過來的縱向樣本進行分析調查。症狀出現後1 - 3個月,RBD特異性記憶B細胞數量增加,COVID-19樣本中RBD特異性記憶B細胞數量顯著高於健康對照組。此外,典型的記憶B細胞表型的數量也在症狀出現後1 - 3個月增加,而Tbet-high記憶B細胞通常在慢性感染中發現,保持較低水平。另外,記憶B細胞可能有助於防止二次感染。
人類組織成像平臺結合多色免疫熒光和定量自動掃描顯微鏡的多光譜成像,已被用於研究從COVID-19死亡患者屍體中獲得的單細胞水平的胸椎淋巴結和脾臟。與需要分離組織的單細胞方法相比,這種方法的優點是可以在很大程度上儲存組織結構,使研究細胞與細胞之間的相互作用成為可能。這些患者淋巴結中生髮中心缺失,同時淋巴結和脾臟中中心B細胞和卵泡輔助T細胞數量顯著減少。以上結果表明,在COVID-19患者(特別是重症COVID-19患者)中觀察到的漿質體比例增加,與抗病毒體液免疫欠佳和疾病相關。
4. T細胞響應
使用流式細胞術檢測COVID-19患者外周血單核細胞的多項研究表明T淋巴細胞減少。在covid -19相關的MIS-C患者中也觀察到類似的T細胞淋巴細胞減少。雖然有報道稱,COVID-19患者和流感患者CD4+和CD8+T細胞數量的減少具有相似性,但一些研究人員觀察到,COVID-19患者CD4+ T細胞數量的減少比流感患者更多。T細胞數量減少也與疾病嚴重程度有關,因為在COVID-19重症患者與中度或輕度患者,或ICU患者與非ICU患者中,CD4+和CD8+ T細胞數量均顯著減少。COVID-19患者中CD4+/CD8+ T細胞比值提示SARS-CoV-2感染可能會優先影響CD8+ T細胞。
T細胞表型:多引數流式細胞術還揭示COVID-19患者出現T細胞的表型和功能改變,主要包括COVID-19中T細胞的過度啟用,其出現表達啟用、增殖或耗竭標記物的亞群升高。與健康對照組相比,在COVID-19患者或重症患者中,活化的(HLA-DR+CD38+、CD38+、HLA-DR+、CD25+CD4+和CD25+CD8+)、增殖的(Ki67+CD8+或Ki67+CD4+)和耗竭的(PD-1+CD8+或PD-1+CD4+、TIGIT+或NKG2A+) T細胞水平顯著增加。急性COVID-19患者中大多數活化的CD8+ T細胞已被證明對SARS-CoV-2具有特異性。然而,也有研究發現可能由於取樣時間的差異,與健康對照組相比,流感患者和COVID-19患者中HLA-DR+CD38+活化的CD8+ T細胞丰度均發生降低。值得注意的是,對BALF樣本中CD8+ T細胞的scRNA-seq和單細胞TCR測序(scTCR-seq)分析發現組織resident記憶T細胞的特徵,以及其與輕度疾病相關的克隆擴充套件水平增加有關,而增殖能力的提高與重症患者相關。對COVID-19和神經後遺症(neuro-covid)患者分離的腦脊液白細胞的scRNA-seq分析發現,與對照組患者相比,表達耗竭標記物的CD4+ T細胞水平較高。
流式細胞術和scRNA-seq也發現COVID-19中T細胞分化和細胞毒性的改變。重症COVID-19患者中細胞毒性CD8+ T細胞的比例高於健康對照組,且其細胞毒性分子表達增加。細胞毒性的增加已被認為有助於上皮損傷。此外,COVID-19患者外周血中樞記憶CD8+ T細胞減少,衰老和效應記憶CD45RA+CD8+ T細胞增加,提示向終末分化傾斜。另一項研究中,在COVID-19患者的胸淋巴結和脾臟解剖組織中,CD4+BCL-6+生髮中心型TFH細胞數量顯著減少,同時濾泡中腫瘤壞死因子(TNF)-α水平升高,1型T輔助(TH1)細胞數量增加。這些結果表明,COVID-19損害TFH細胞的分化可能導致上述生髮中心的缺失。
T細胞特異性:透過多種基於流式細胞術的技術,如細胞內細胞因子染色、啟用誘導的標記物分析和主要組織相容性複合體(MHC)多聚體分析等,在急性COVID-19患者和恢復期患者中發現存在尖峰和非尖峰表位的SARS-CoV-2特異性T細胞,表明感染後會形成病毒特異性記憶T細胞。儘管重症COVID-19患者的SARS-CoV-2特異性T細胞響應總體上比輕症患者表現出更高的廣度和量級,但輕症患者中SARS-CoV-2特異性CD8+ T細胞的比例高於重症患者。SARS-CoV-2特異性CD4+ T細胞主要是TH1細胞,主要表現為中樞記憶T細胞表型,而SARS-CoV-2特異性CD8+ T細胞在效應記憶和終末分化效應亞群中更豐富。對SARS-CoV-2響應性CD4+ T細胞的scRNA-seq和scTCR-seq分析顯示, SARS-CoV-2特異性細胞毒性CD4+ T細胞和細胞毒性TFH細胞增加與疾病嚴重程度之間存在關聯,調節性T細胞與疾病嚴重程度之間存在反向關聯。在重症患者中,SARS-CoV-2響應性CD8+ T細胞的細胞毒性和炎症基因表達增強,TCR克隆擴增水平升高,支援過度啟用的抗原特異性T細胞與COVID-19發病機制相關。由於體外刺激可以從根本上改變響應性T細胞的基因表達譜,進一步使用MHC多肽和單細胞測序的研究可以為SARS-CoV-2特異性T細胞的表型和功能提供進一步的見解。此外,單細胞多組學技術,如轉座酶可及染色質單細胞測序(scATAC-seq)技術,可用於研究SARS-CoV-2特異性T細胞是否保留可能決定其記憶響應的表觀遺傳指紋(fingerprints)。
T細胞對COVID-19免疫的貢獻:接觸地方性冠狀病毒和交叉響應性記憶T細胞免疫如何塑造對SARS-CoV-2的免疫應答,仍存在許多問題。細胞內細胞因子染色和流式細胞術、酶聯免疫吸收斑點(ELISpot)和熒光斑點檢測是檢測未暴露於SARS-CoV-2的個體中交叉響應性記憶CD4+ T細胞的關鍵單細胞技術,而交叉響應性記憶CD8+ T細胞則不常見。據推測,交叉響應性記憶CD4+ T細胞可能透過促進B細胞和抗體反應,或透過介導感染部位(包括肺部和上呼吸道)的快速區域性抗病毒免疫,提供對SARS-CoV-2感染的保護性免疫,並降低疾病嚴重程度。然而,據報道,預先存在的交叉響應性記憶CD4+ T細胞可能不僅具有低TCR,克隆擴張降低,而且還會加劇炎症和疾病嚴重程度,特別是在老年人中。因此,先前存在的交叉響應性記憶T細胞在一般人群中SARS-CoV-2感染和疫苗接種中的作用值得進一步研究。
5.單細胞水平的免疫保護相關因素
隨著COVID-19免疫學單細胞資料集的快速增長,如何利用當前和新興的公共資料集是醫學家和研究者們面臨的問題之一。正在進行的COVID-19候選疫苗療效試驗生成單細胞免疫圖譜資料集,這些資料集可以被用於識別風險相關因素以及保護相關因素。由於COVID-19疫苗有效性試驗的樣本量有限,且有大量的免疫生物標誌物可能被評估為相關因素,因此開展試點研究以最佳化和識別具有良好統計特性的相關分析方法和相關免疫特徵至關重要。確定最佳相關性的重要因素包括:高可重複性、大規模的疫苗接種者、低假陽性率等。為加快相關分析,現有的單細胞資料集可以被用來最佳化和識別可重複性較高的單細胞免疫訊號。
這些整理資料集的另一個主要應用是基於整合分析和meta分析識別可能參與SARS-CoV-2進展的相關因素等,例如最近對107個肺scRNA-seq研究的薈萃分析,發現可能參與SARS-CoV-2感染的蛋白酶。
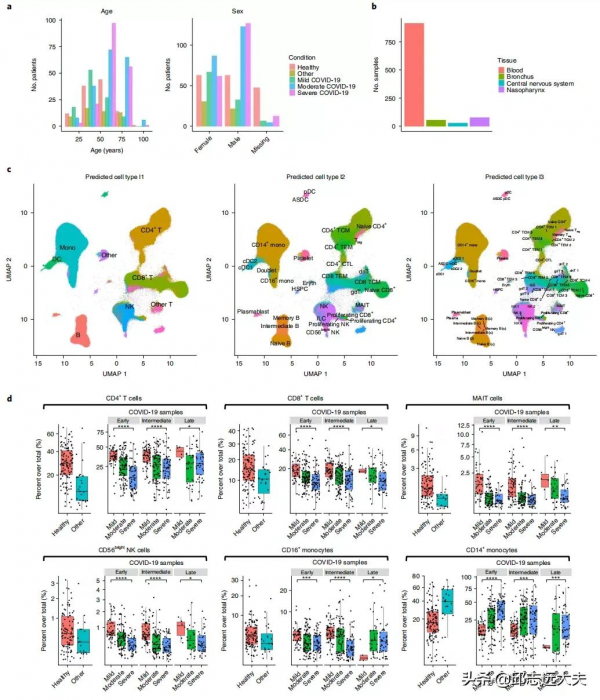
圖2展示出一種將公開可用的單細胞資料組織起來用於綜合分析的方法。收集的21個數據集中個體的年齡(左)和性別(右)分佈如圖2a所示。組織型別的樣本數量如2b所示。基於UMAP對來自於16個PBMC和全血來源的超過250萬個單細胞對映到Seurat CITE-seq參考中,並透過參考定義的細胞型別對細胞進行著色和標記(圖2c)。並基於Wilcoxon檢驗識別不同狀態,不同症狀程度,不同時間節點樣本中CD4+ T細胞、CD8+ T細胞等細胞丰度間的差異(圖2d)。
圖2. 單細胞轉錄組資料的視覺化表示
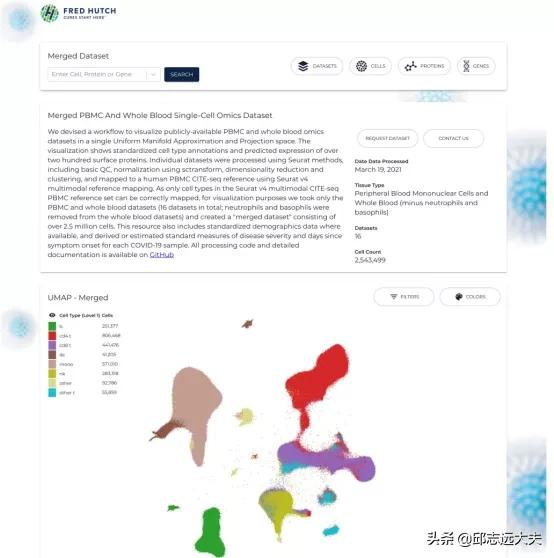
此外,研究者們對21個已釋出的單細胞測序資料集(超過320萬個細胞)進行整合概況,提供標準化、質量控制後可下載版本的資料以及UMAP對映圖展示,並構建一個可用於資料探索的互動式視覺化網站(https://atlas.fredhutch.org/fredhutch/covid)。
圖3. 視覺化網站示例
該網站提供特定資料集以及整合資料集探索分析。
提供相應資料集合的資料來源,組織來源,細胞型別等資訊展示。
對於選定資料集合提供細胞,蛋白,基因搜尋功能。
從而得到相應細胞中發生差異表達的基因。
以及相應蛋白或者基因的UMAP對映圖。
COVID-19的單細胞資料有了,但是分析思路不清晰怎麼辦呢?彆著急,下面小編將以兩篇文章為例簡單介紹下COVID-19單細胞免疫分析思路。
第一項工作為表徵COVID-19患者的免疫學特徵,研究者對13例新冠患者和5例健康捐獻者(HDs)的PBMCs進行scRNA-seq分析,最終得到122,542個細胞的單細胞轉錄譜。並將13例COVID-19患者分為三種臨床情況:中度(n=7),重度(n=4)和恢復期(n=6例,其中4例與中度病例配對),分析不同細胞條件下細胞組成,並進行差異基因分析以及B細胞,T細胞的亞型特點分析。此外,還對每個受試者進行單細胞T細胞受體(TCR)和B細胞受體(BCR)測序分析[2]。
COVID-19患者的免疫學特徵分析
第二項工作透過對196名COVID-19患者和正常對照組的284份樣本進行單細胞RNA測序,建立一個包含146萬個細胞的全面免疫圖譜。透過對免疫圖譜資料進行分析,可以確定外周免疫亞型的變化與不同的臨床特徵相關,包括年齡、性別、嚴重程度和COVID-19的疾病分期。此外,SARS-CoV-2 RNA存在於多種上皮細胞和免疫細胞中,並伴有病毒陽性細胞的轉錄組學改變。外周血中主要由巨核細胞和單核細胞引起的S100A8/A9系統性上調可能會導致重症患者常見的細胞因子風暴[3]。
大規模COVID-19的單細胞免疫圖譜
自21年下半年初始,COVID-19疫情在我國多點散發,頗有點“你方唱罷我登場”甚至想要的兇猛反撲的架勢。冬奧臨近,身為半個醫學生的我們在小心謹慎,做好個人防護的同時,也別忘了對COVID-19致病機制和預防控制方面進行深入研究哦。
好啦,各位小夥伴,今天的內容就是這些,對COVID-19單細胞免疫分析感興趣的朋友一定要認真學習下今天的這幾篇文章哦,我們下次再見啦。