原創 奇點糕
免疫檢查點抑制劑(ICB)一直都備受醫學界的追捧。在2018年,諾貝爾生理學或醫學獎更是被頒給了兩位免疫學家,以表彰他們“發現負性免疫調節治療癌症的療法方面的貢獻” [1]。可是,臨床上免疫檢查點抑制劑在結直腸癌患者中的治療有效率僅為15%。
造成這種療效異質性的現象在一定程度上歸結於免疫細胞的浸潤程度不同,尤其是CD8+T細胞的浸潤。CD8+T細胞在結直腸腫瘤中的高度浸潤(“熱腫瘤”)不僅能夠提示良好的預後,還能預示患者對免疫治療的有效性。而大部分患者都呈現出“冷腫瘤”的狀態,也就是在腫瘤中只存在少量浸潤的CD8+T細胞,因而降低了ICB對結直腸癌的治療療效。
所以,如何把“冷腫瘤”改造成“熱腫瘤”也就成為了大家研究的焦點!
為了解決這一問題,近日,北京協和醫院的花芳教授和張海增主任共同領導的課題組,在Science Translational Medicine發表了重要的研究成果[2]。
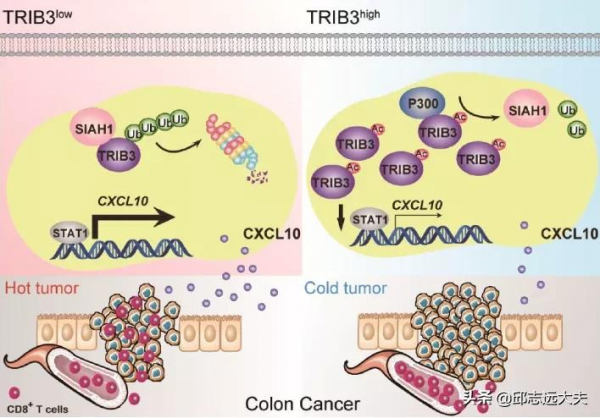
研究發現,結直腸癌中的一種促癌蛋白TRIB3會抑制STAT1-CXCL10訊號通路,進而減少CD8+T細胞的浸潤。如果用藥物靶向降低TRIB3蛋白的穩定性,可以逆轉這一現象,從而增強免疫檢查點抑制劑的療效。
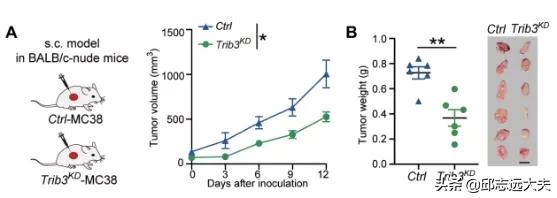
現在我們就一起來看看這個研究是如何開展的。前期研究已經證明促癌蛋白TRIB3能夠促進結直腸癌的乾性和腫瘤進展。越來越多的研究也發現TRIB3具有免疫調節的功能。為了進一步探索TRIB3在結直腸癌中潛在的免疫調節作用,本研究聚焦於TRIB3對CD8+T浸潤產生的影響。首先,研究人員將對照和敲低Trib3基因(Trib3KD)的小鼠結直腸癌MC38細胞系分別皮下種植於免疫正常鼠和免疫缺陷鼠。結果發現,相比於對照組,Trib3KD細胞在兩種小鼠中都顯示出腫瘤負荷降低的現象。值得注意的是,在不同老鼠模型中腫瘤負荷降低的程度卻顯著不同:即相較於對照組而言,Trib3KD組在免疫正常小鼠中的腫瘤負荷下降了80%,而在免疫缺陷鼠中只有50%。由此,他們推斷TRIB3可以介導抗腫瘤的免疫調節功能。進一步的實驗也證實了這一猜想,相較對照組而言,移植Trib3KDMC38細胞的小鼠瘤內功能性CD8+T細胞的浸潤增加。
Trib3KD細胞在免疫正常小鼠中腫瘤負荷下降80%,而在免疫缺陷鼠中只有50%
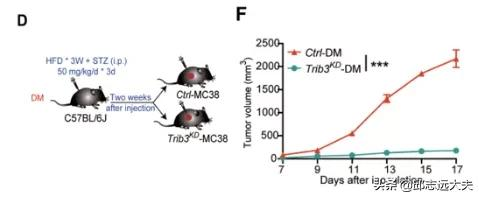
肥胖可以誘導TRIB3表達[3]。透過比較肥胖結直腸癌和非肥胖結直腸癌患者的腫瘤組織樣本,他們觀察到了和小鼠模型一樣的現象,即高表達TRIB3的肥胖結直腸患者樣本中顯示出更少浸潤的CD8+T細胞。為了進一步驗證,他們採用了肥胖小鼠模型。結果和患者樣本一致,與非肥胖的小鼠相比,肥胖小鼠呈現出高表達TRIB3、腫瘤高增殖、而少殺傷性的CD8+T浸潤的特點。另外,在肥胖小鼠模型中皮下種植Trib3wtMC38和Trib3KDMC38細胞,Trib3KD MC38組中的腫瘤幾乎不生長。
在肥胖小鼠模型中,Trib3KD腫瘤幾乎不進展
到這裡,該團隊已經確定了TRIB3可以透過調節CD8+T細胞的浸潤,來達到影響結直腸癌的形成和生長的目的。接下來,他們進一步去分析了TRIB3調控結直腸癌的機制。趨化因子是招募CD8+T細胞的重要因素[4]。那TRIB3調控CD8+T細胞的浸潤是不是透過趨化因子介導的呢?如果是,又是哪一個趨化因子呢?帶著這些疑問,他們先用熒光微球流式細胞實驗(CBA)對多種趨化因子進行了篩選,發現CXCL10在Trib3KDMC38細胞中表達明顯增高,且CXCL-10的中和性抗體能夠有效地抑制CD8+T細胞的遷移。除此以外,他們還建立了CXCL-10/TRIB3雙過表達模型(Cxcl10OETrib3OE)進行體內實驗,也得到了一致的結果,CXCL10OE可以抑制TRIB3OE的促腫瘤作用。
體內實驗顯示過表達CXCL-10可以抑制Trib3OE促腫瘤能力
據報道,STAT1,NF-κB和CREB均是可以調節CXCL10表達的轉錄因子[5]。他們分別敲低STAT1,NF-κB和CREB,發現敲低STAT1後可以逆轉Trib3KD引起的CXCL-10增高趨勢,而NF-κB和CREB均不可以。進一步實驗證明TRIB3調節STAT1/CXCL-10通路是透過STAT3/EGFR來介導的。到此,該團隊已經明確,TRIB3-STAT1-CXCL10通路可以重建腫瘤微環境,調節CD8+T細胞的浸潤。但是,還有一個大問題沒有解決:到底什麼影響TRIB3的表達?以往的研究和本研究前面的結果已經表明高糖調節和肥胖可以促進TRIB3的表達,所以,他們用高糖去處理結直腸癌細胞系,發現Trib3的轉錄水平沒有變化,但是TRIB3蛋白水平明顯增多。這個結果也意味著高糖是透過增加TRIB3蛋白的穩定性來增高其蛋白的表達量。高糖可以給腫瘤細胞提供足夠的能量來源,並且產生大量的乙醯輔酶A(CoA),而CoA又能進一步將蛋白進行乙醯化修飾[8]。檢測也發現,高糖處理能乙醯化修飾TRIB3。進一步實驗確定了組蛋白乙醯轉移酶P300可以介導TRIB3蛋白的K240位點乙醯化,這對於CD8+T細胞的浸潤是不利的。
TRIB3 K240位點的乙醯化抑制CD8+T的遷移
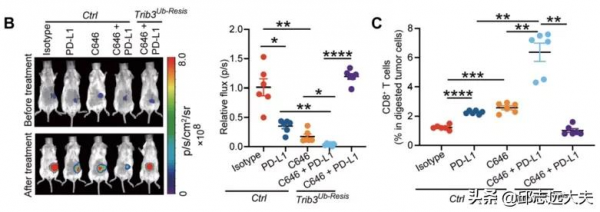
既然TRIB3的乙醯化修飾對抗腫瘤免疫具有負面作用,那麼,TRIB3乙醯化的拮抗劑是否能夠促進抗腫瘤治療呢?因此,他們聯用C646(乙醯化抑制劑)和PD-L1抗體治療CT26原位結直腸癌。結果顯示,不管是單獨使用C646還是PD-L抗體,都能夠部分限制腫瘤進展,而兩者聯用可以顯著增加抗腫瘤療效。機制也和前面的結果一致,聯合治療能夠增加CD8+T細胞的浸潤,伴隨著TRIB3表達量明顯降低,而CXCL10,STAT1和p-STAT1則明顯增高。
C646和PD-L1的聯用明顯增加CD8+T細胞的浸潤
這個研究不僅明晰了肥胖人群易患腫瘤的機制,也為未來對於結直腸癌患者的治療提供了潛在的靶點。
TRIB3影響腫瘤免疫微環境機制示意圖