歡迎關注凱萊英藥聞
Glypican-3(GPC3)基因位於染色體Xq26上,主要編碼具有580個氨基酸的70000 Da前體核心蛋白,也被稱為DGSX、GTR2-2、MXR7、OCI-5等,該蛋白可被切割為40 000 Da的N末端蛋白和可被單克隆抗體識別的C端蛋白。GPC3是硫酸乙醯肝素糖蛋白(HSPGs) 家族的一員,透過糖基磷脂醯肌醇(GPI)錨連線於細胞膜上,廣泛表達於人類胚胎。GPC3可透過胰島素樣生長因子、骨有關形成發生蛋白、成纖維細胞生長因子(FGF) 或Hedge-hog訊號調節細胞形態形成和生長,與多種細胞表面受體的相互作用調節其下游訊號通路,從而調節細胞的黏附、增殖分化、侵襲遷移等生物學行為。
GPC3在多種實體腫瘤中高表達,而在成人正常組織中含量極少,因此有望成為多種實體瘤的治療靶點。在成人組織中,GPC3只低表達於心髒、肺臟、腎臟和卵巢,極少量表達於骨骼肌、胰腺、小腸和結腸。與此同時,GPC3在腫瘤組織中的表達具有差異性:在肝細胞瘤(HCC)、非小細胞肺癌、睪丸和卵巢卵黃囊瘤、惡性黑色素瘤、卵巢透明細胞癌(OCCA)、特殊型胃癌(GC)、ESCC、睪丸生殖細胞瘤、結腸癌、腎橫紋肌樣瘤中為高表達,然而在卵巢癌、膽管癌、GC和間皮瘤中表達下調,被認為是這些腫瘤的抑制基因。
國際上近年批准上市的肝癌靶向藥物寥寥無幾,眾多III期臨床研究以失敗告終。異質性被認為是腫瘤不能被治癒的最主要原因,而肝癌是異質性最強的惡性腫瘤之一。肝癌的高度異質性,使其至今為止沒有發現相關的“癌基因依賴”,因此分子靶向療法的療效甚微。其中,HCC約佔所有肝癌的90%。據弗若斯特沙利文的統計,2019年全球HCC患者人數達77.6萬人,預計於2024年將增加至87.66萬人,於2030年增加至100萬人,2024年至2030年的複合年增長率為2.3%。我國是肝癌的高發國家,超過45%的HCC病例來自中國。我國的HCC患者人數於2019年達36.94萬人,預計於2024年增長至41.65萬人並於2030年增長至47.34萬人,2024年至2030年複合增長率為2.2%。目前,針對HCC的治療水平已大幅提升,從傳統的化療發展為多激酶抑制劑和檢查點抑制劑治療,但總體治療選擇仍然十分有限,尤其是對於晚期肝癌患者,僅有少量的二線和後續治療選擇。因此,晚期HCC患者仍存在巨大未滿足的臨床需求。研究表明,GPC3是HCC的可靠標誌,可以在HCC早期協助確認病變的性質,可顯著提高診斷的準確性。此外,基於GPC3靶點的治療策略則主要集中在抗體藥物,細胞治療以及疫苗等方面[1-3]。
一、最新研究進展
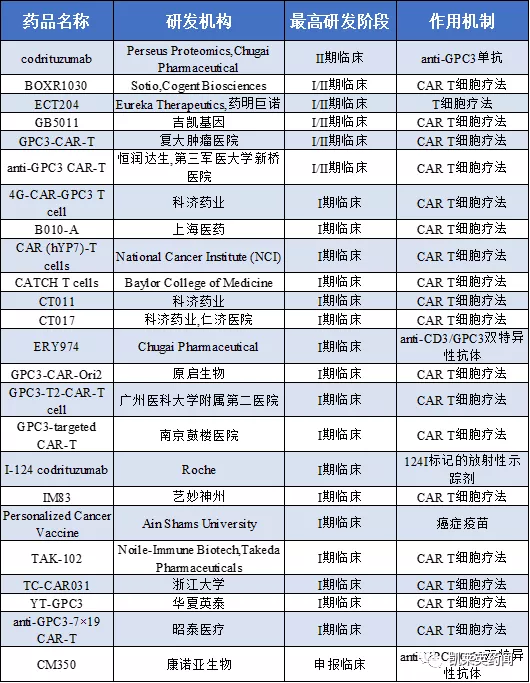
1、據不完全統計,目前處於在研階段的GPC3藥物38個,其中II期臨床1個,I/II期臨床5個,I期臨床17個,申報臨床1個,臨床前14個。
2、研究企業情況及適應症:其中科濟藥業在研3個、羅氏在研3個,藥明巨諾在研2個,Cytovia在研2個,National Institutes of Health (NIH)在研2個,康諾亞生物在研1個,Boston Pharmaceuticals在研1個,Medarex在研1個,藝妙神州在研1個。適應症以實體瘤,特別是肝細胞瘤為主。
3、將臨床以上階段的藥物及作用機制統計如下:
二、重點藥物及企業介紹
1、GPC3抗體
作為一個創新靶點,GPC3的研發管線並不擁擠,絕大多數單抗仍處於臨床前階段。羅氏旗下中外製藥(Chugai Pharmaceutical)的codrituzumab(GC33)是首個靶向GPC3的抗體,目前處於臨床II期。但GC33的臨床之路並不順利,屢次遭遇滑鐵盧。一項針對GC33在晚期轉移性肝細胞癌患者的有效性的II期臨床顯示,GC33與安慰劑作對照在患者的總生存期和無進展生存期上均沒有顯著差異。GC33與安慰劑對比的mPFS為2.6個月vs1.5個月,mOS為8.7個月vs10個月。但是此項臨床的亞分析結果表明,GC33可以改善GPC3過表達肝細胞癌患者的預後。2021年6月,中外製藥重新啟動了關於codrituzumab的I期試驗,繼續挖掘靶向GPC3的單克隆抗體在實體瘤中的臨床價值。
此外,中外製藥在GC33的基礎上還開發了一款靶向CD3/GPC3的雙特異性抗體,即ERY974。ERY974抗體帶有2個不同的可變區,其中一個識別腫瘤抗原GPC3,另一個用於結合表達CD3抗原的T細胞。雙特異性抗體在T細胞和腫瘤細胞之間構成了免疫突觸,將T細胞召集到腫瘤部位,從而啟用T細胞免疫機制,介導T細胞殺傷GPC3過表達的腫瘤細胞。在劑量爬坡I期試驗中,共入組29例受試者,劑量範圍為0.003-0.81μg/kg。結果顯示,20%以上的患者出現CRS反應和發熱。0.81μg/kg劑量被證實不耐受;劑量低於0.81μg/kg時,ERY974耐受性良好,經過類固醇和抗IL-6R治療後毒副作用可控。近期,針對ERY974開展了一項新的I期臨床研究,旨在評價ERY974聯用阿替利珠單抗(PD-L1)及貝伐珠單抗(VEGF)用於晚期肝細胞癌患者的安全耐受性和初步療效資料,目前患者正在招募中。
2、CAR-T
BOXR1030是SOTIOBiotech公司領先的CAR-T專案,用於治療表達GPC3的各種實體瘤。它基於專有的BOXR平臺,旨在提高T細胞在惡劣的腫瘤微環境中的適應性。臨床前研究已經確定了BOXR1030的“bolt-on”轉基因的作用機制,並證明了BOXR1030對抑制性腫瘤微環境具有抗性,與傳統的GPC3 CAR-T細胞對比,在低氧和低葡萄糖條件下,均顯示出T細胞增殖得到改善,具有更好的腫瘤殺傷能力;此外,在動物分離出的腫瘤浸潤淋巴細胞中,對比對照細胞,BOXR1030對功能障礙的抵抗力更強,並且衰竭的標誌物更少。BOXR1030的臨床研究計劃預計於2022年初開始。2021年12月,SOTIOBiotech宣佈已獲得2.8億歐元的資金,以顯著擴大和推進其臨床管道。
SOTIO的研發管線(圖片來源:官網)
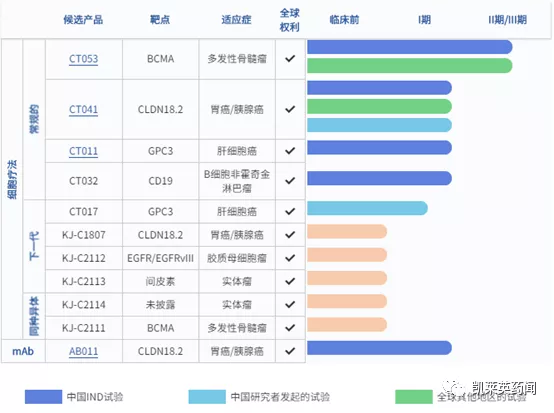
科濟藥業的管線有2款靶向GPC3的CAR-T治療產品,分別是CT011和CT017,均已進入I期臨床。其中CT011治療GPC3陽性實體瘤的臨床試驗申請於2019年獲得國家CDE的默示許可,2020年在Clinical Cancer Research刊登臨床結果,是全球首個靶向GPC3 CAR-T細胞治療肝細胞癌的藥物。研究在經過手術治療、區域性治療或全身系統治療後病情發生進展的患者中開展,臨床結果顯示,半年、1年、3年的生存率分別為:50.3%、42.0%和10.5%;PR(部分緩解)率達15%(2例),2例患者的生存時間分別達20.5個月和44.2個月;中位生存期為278天。安全性方面,在13例、12例和9例患者中分別觀察到發熱、淋巴細胞計數減少和CRS現象;8例患者出現1/2級CRS反應,1例患者出現5級CRS反應;沒有患者發生3/4級神經毒性反應。此項結果表明,科濟生物靶向GPC3的CAR-T療法在人體內安全可控,且在晚期肝細胞癌患者中表現出一定的療效。而基於新一代CAR-T技術平臺CycloCAR開發的CT017,體內研究結果表明,在3種小鼠實體瘤模型(胰腺癌、乳腺癌和肝癌)中並且無需環磷醯胺預處理的條件下,較傳統CAR-T細胞或IL-7/CCL19共表達的CAR-T細胞表現出更為顯著的療效。IL-7和CCL21可以改善腫瘤中CAR-T細胞和DC細胞的存活和浸潤;免疫組化證實了CCL21可以抑制腫瘤的血管生成。
科濟藥業的研發管線(圖片來源:官網)
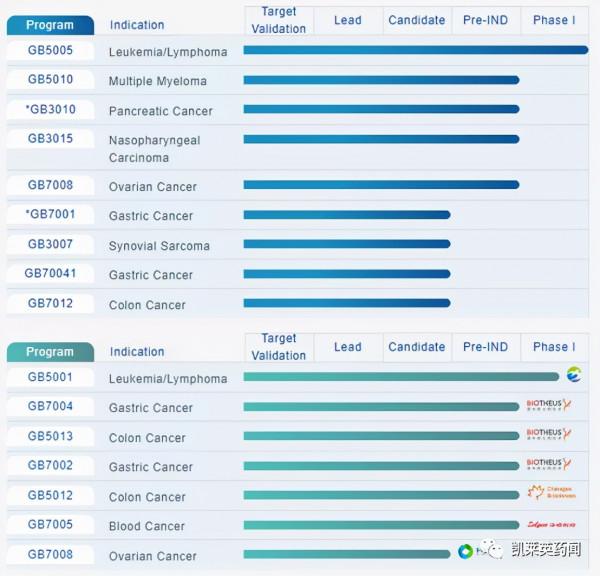
吉凱基因開發的GB5011同樣是一款靶向GPC3的CAR-T療法,目前正在開展探索性臨床I/II期研究,截至目前吉凱基因並未向CDE提交臨床申請。除科濟藥業和吉凱基因外,華夏英泰、北京藝妙、恆潤達生、上海醫藥、艾貝樂醫藥和原啟生物等均在開發GPC3靶向CAR-T療法,國內本土企業有望獲得GPC3領域的突破。
吉凱基因的研發管線(圖片來源:官網)
展望
儘管GPC3在HCC發生、發展中的作用機理還不是完全清楚,但其對HCC的診斷與治療方面的影響已經顯現。GPC3在病理學診斷方面,是診斷HCC的可靠指標之一;而其作為HCC分子靶向治療的作用靶點,將為HCC的治療拓展新的途徑。相信隨著對GPC3分子作用機制研究的不斷深入,其應用前景將更加廣闊。
參考文獻
[1] Feng M, Ho M. Glypican-3 antibodies: a newtherapeutic target for liver cancer[J]. FEBS letters, 2014, 588(2): 377-382.
[2]Murthy S S, Shen T, De Rienzo A, et al.Expression of GPC3, an X-linked recessive overgrowth gene, is silenced inmalignant mesothelioma[J]. Oncogene, 2000, 19(3): 410-416.
[3] Peters M G, Farias E, Colombo L, et al.Inhibition of invasion and metastasis by glypican-3 in a syngeneic breastcancer model[J]. Breast cancer research and treatment, 2003, 80(2): 221-232.
[4] Chen C, Huang X, Ying Z, et al. Can glypican-3be a disease-specific biomarker?[J]. Clinical and translational medicine, 2017,6(1): 1-6.