本文來自微信公眾號:X-MOLNews
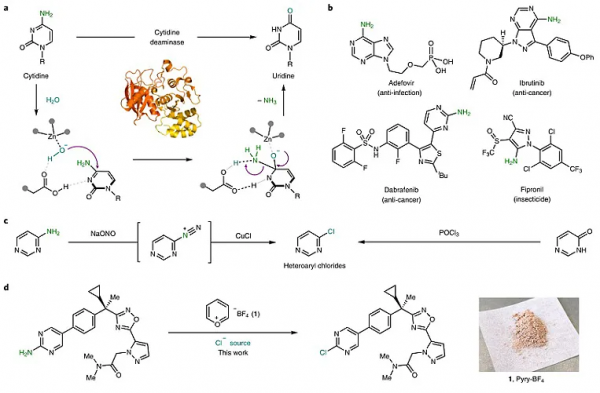
對於複雜分子的修飾,要是能像玩積木一樣想換哪個官能團就換哪個官能團,那該有多好?實際上,自然界中這種精確的分子修飾並不少見,生物體內複雜的酶生化系統可以實現複雜分子特定基團的安裝或拆卸。例如:酶在Zn離子輔助作用下,能夠選擇性將胞苷脫氨基轉化為尿苷(圖1a)。但如果放到化學實驗室中,這一過程就頗有難度了。C(sp2)-N 鍵的解離能較高,而氨基(NH2-)又是極差的離去基團,有機合成領域還沒有成功複製這一過程的報道。然而,氨基雜環又是許多生物活性化合物(如:殺菌劑、除草劑、藥物分子、天然產物、維生素、DNA、RNA等)的核心骨架(圖1b),這意味著將氨基轉化為模組化且通用的離去基團十分重要。如圖1c所示,目前將C(sp2)-NH2轉化為C(sp2)-Cl仍然是透過經典的Sandmeyer反應實現,但是底物範圍侷限、強氧化性和酸性條件下的官能團耐受性、安全性等問題嚴重阻礙了其應用。
圖1. 對氨基的選擇性修飾、現有技術和挑戰。圖片來源:Nat. Chem.
受Vilsmeier型反應的啟發(圖1c),德國馬克斯•普朗克煤炭研究所的Josep Cornella課題組將Sandmeyer反應起始原料的可用性與Vilsmeier 反應獲得的雜芳基鹵化物的有用性相結合,利用商業可得的吡喃鎓試劑(Pyry-BF4,1)和各種氯化物來源將雜芳香族化合物中的氨基順利地轉化為雜芳基氯化物(圖1d)。該方法不僅底物範圍廣、官能團耐受性好,而且對結構複雜的藥物分子、農業化學品以及天然產物等的後期修飾也有很好的效果。此外,溴離子和氟離子也可以實現這一轉化,從而得到相應的鹵化產物。相關成果於近日發表在Nature Chemistry 上。
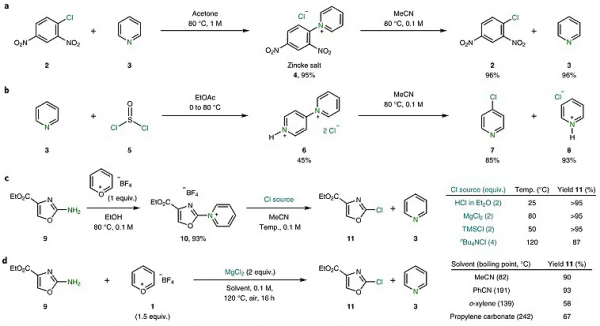
作者的研究始於溶液中觀察到Zincke鹽析出的有趣現象,即1-氯-2,4-二硝基苯(2)在吡啶(3)的存在下回流時,Zincke鹽(4)會定量析出,並且易於過濾分離和純化(圖2a)。若將(4)溶解在MeCN時,(2)和(3)以1:1的比例部分生成,這說明Zincke鹽(4)的形成是一個可逆過程,並且提高溫度和稀釋溶液能以接近定量的收率回收1-氯-2,4-二硝基苯(2)和吡啶(3)。受上述現象啟發,作者嘗試使用吡啶(3)和二氯亞碸(5)進行上述反應,同樣可以觀察到上述有趣的現象,這進一步說明該現象不僅可以活化芳基部分,還可以拓展到雜芳環底物(圖2b)。基於此,作者將吡喃鎓試劑Pyry-BF4(1)與惡唑(9)進行反應,順利地獲得了四氟硼酸吡啶鎓(10),同時還篩選了不同的氯離子源以實現C(sp2)-N鍵向C(sp2)-Cl鍵的轉化。如圖2c所示,醚化的HCl溶液、非Brønsted 酸性抗衡離子MgCl2、三甲基氯矽烷(TMSCl)和非配位陽離子nBu4NCl均可以優異的收率獲得相應的氯化產物(11)。為了使該反應更方便更實用,作者嘗試了一鍋法的合成策略,最終以高產率實現了吡啶鹽的形成和隨後的原位氯化(圖2d)。為了提高該方法的轉化潛力,作者證明比MeCN沸點更高的替代溶劑(如:苯甲腈、鄰二甲苯或碳酸丙烯酯)均可適用這一轉化。
圖2. 脫氨氯化初步探索和最佳化。圖片來源:Nat. Chem.
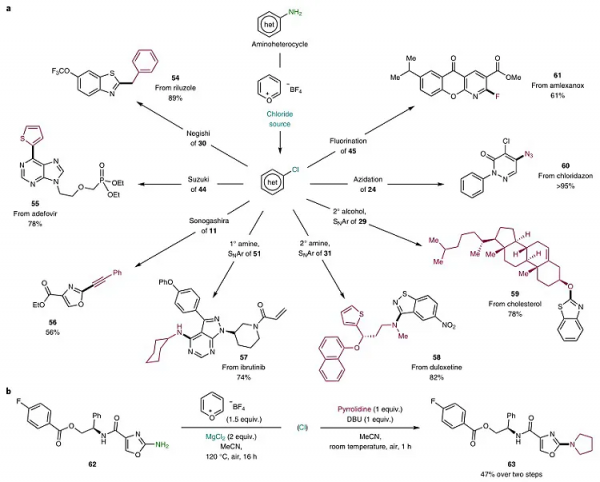
對不同氯源進行考察後,作者對氨基雜環的底物範圍進行了探索。如圖3所示,調節溫度對4-和2-氨基吡啶(7、12-20)的產率和官能團耐受性至關重要。另外,二嗪類底物,如嘧啶(21、22)、噠嗪(23)、除草劑氯噠嗪酮(24)、吖啶(25)、稠合雜環(26、27),也能相容該反應,以中等至良好的收率得到所需的氯代產物。值得一提的是,該策略還能耐受五元雜環(11、28-32),而先前基於Vilsmeier的策略則無法實現這一轉化。隨後,作者對噁唑類化合物的官能團耐受性進行了考察,研究發現:鹵素原子(Cl、I、Br、F)、吡啶基、肉桂基、氰基、甲碸基甚至醛基(33-40)均可耐受該反應。類似地,帶有三個雜原子且易開環的雜環化合物,如噻二唑(41)、惡二唑(42),也可以高產率順利實現氯化反應,而在遊離仲醇(43)中新增nBu4NCl也可避免Mg誘導的副反應發生。此外,該方法還能實現結構複雜且具有活性的生物分子的後期修飾,例如:抗乙肝病毒阿德福韋的前體(44)、抗炎抗過敏免疫調節劑氨來佔諾酯(45)、來自阿莫沙平、帕羅西汀或含有 SF5結構單元的噻唑衍生物(46-48)、5-脂氧合酶啟用蛋白抑制劑(BI-665915)(49)、殺蟲劑氟蟲腈(50)、抗癌症藥依魯替尼(51)和達帕菲尼(53)以及磺胺多辛的苯並噻唑衍生物(52)。最後,作者還對此方法的有效性進行了全面的評估,結果顯示底物(24、30、32)在先進的Sandmeyer條件下的產率均低於此策略。儘管他們並未對全部的底物進行測試,但這10種有挑戰性的底物均沒有檢測到產物,這進一步體現了該方法的強大。
圖3. 氨基雜環的底物範圍研究。圖片來源:Nat. Chem.
在解鎖後期脫氨氯化策略後,作者對芳基氯化物的後期衍生化進行了探究。如圖4a所示,芳基氯化物不僅能實現C(sp2)-C(sp2)、C(sp2)-C(sp3)和C(sp2)-C(sp)交叉偶聯反應(Negishi 54, Suzuki 55和 Sonogashira 56),而且還能實現親核取代反應,從而獲得相應的脂肪胺(57、58)、仲醇(膽固醇59)、疊氮化物(60)以及氟原子(61)修飾的產物。為了突出該方法的實用性(圖4b),作者從62出發,以兩步47%的收率實現了吡咯烷的官能團化,並且中間體無需純化。
圖4. 氨基雜環氯化產物的廣泛可用性。圖片來源:Nat. Chem.
如圖5a所示,底物64的脫氨氯化反應還能以克級規模進行,同時收率沒有降低。需要指出的是,脫氨鹵化策略還可以擴充套件到其它鹵素,例如:五元或六元環底物(65、67)能夠在LiBr或MgBr2為溴源的條件下順利溴化(圖5b)。類似地,氟化物也可被視為親核試劑,只不過需要預先製備吡啶鎓鹽(圖5c),而後加入嚴格乾燥的KF,並且氟化反應具有一定的底物適用性(69-73)。需要指出的是,在不能排除水的情況下,反應獲得了吡啶開環產物。此外,較溫和的親核試劑(如Cl或Br)對吡啶的C2或C4位進攻是可逆的,直到ipso位受到攻擊,此過程才變得不可逆,並最終導致吡啶和芳基氯的形成(圖5d)。
圖5. 脫氨氯化克級放大、溴化、氟化以及機理研究。圖片來源:Nat. Chem.
總結
在天然脫氨酶的啟發下,Josep Cornella課題組利用商業可得的Pyry-BF4,將C(sp2)-NH2基團高化學選擇性地轉化為C(sp2)-Cl。該方法不僅能適用於超過20種不同型別的雜環基團,包括含有N、O 和 S 原子的五元和六元環,而且具有很好的官能團耐受性,甚至還能用於結構複雜且具有生物活性的藥物分子、農業化學品以及天然產物等的後期修飾,同時還可以拓展至溴化和氟化反應。毫無疑問,脫氨氯化反應為化學工作者提供了一種探索未來化學空間以及加速藥物研發過程的替代工具。
Deaminative chlorination of aminoheterocycles
Clément Ghiazza, Teresa Faber, Alejandro Gómez-Palomino, Josep Cornella
Nat. Chem., 2021, DOI: 10.1038/s41557-021-00812-0
(本文由吡哆醛供稿)