自2017年首款CAR-T療法上市以來,全球已有5款CD19 CAR-T和1款BCMA CAR-T療法獲批,累計適應證包括急性淋巴細胞白血病、瀰漫性大B細胞淋巴瘤、原發縱隔B細胞淋巴瘤、套細胞淋巴瘤、濾泡性淋巴瘤和多發性骨髓瘤。
在CAR-T治療惡性血液腫瘤取得革命性進展的同時,科學家和藥物研發人員也在積極探索這類免疫細胞療法其他的治療潛能,包括治療實體瘤,以及其他疾病,如自身免疫性疾病、HIV感染等。
封面論文:在進入血液和組織中後,脂質奈米顆粒(球)利用覆蓋在表面的靶向CD5蛋白的抗體(抗體藍色,CD5蛋白紅色)來特異性靶向T細胞;奈米顆粒將封裝在其中的mRNA傳遞給T細胞,在體內直接對T細胞進行重程式設計,使其瞬時表達能夠靶向致病性心臟成纖維細胞的嵌合抗原受體(金色)。(來源:Science)
1月6日,賓夕法尼亞大學Perelman醫學院的科學家們在Science雜誌以封面論文的形式釋出了CAR-T治療心臟損傷的突破成果。研究顯示,透過注射包含mRNA的CD5靶向脂質奈米顆粒(LNP),能夠在體內完整地產生治療性CAR-T細胞。對心臟疾病小鼠模型的分析表明,這種創新的治療方法能夠成功減少纖維化以及恢復心臟功能。
這項成果不僅代表了CAR-T適應證拓展方面的重要突破,更是體內CAR-T療法領域的一項里程碑進展。研究者們認為,利用修飾的mRNA在體內直接產生CAR-T細胞可能有廣泛的治療應用。
來源:Science
心力衰竭在一定程度上由活化的心臟成纖維細胞引起,這類細胞透過長期過量產生使心臟肌肉變硬,損害心臟功能的纖維物質(這一過程即心臟纖維化),來響應心臟損傷和炎症。因此,科學家們設想,能否設計一種CAR-T細胞來攻擊活化的心臟成纖維細胞。
目前上市以及在研的CAR-T療法大多數是指從患者體內分離出T細胞,然後在體外對T細胞進行改造,使其表達能夠識別癌細胞表面抗原(如CD19、BCMA)的嵌合抗原受體(CAR),接著再將CAR-T細胞進行擴增,最後回輸到患者體內,發揮消滅癌細胞的作用。
然而,與抗癌相比,利用這種傳統的CAR-T細胞療法來治療人類心臟衰竭或其他纖維化疾病面臨著獨特的挑戰。因為,成纖維細胞本身在體內也具有正常而重要的功能,特別是在傷口癒合方面。由於傳統CAR-T細胞輸注到患者體內後可以存活數月甚至數年,因此會持續抑制成纖維細胞的數量,損害傷口癒合(在癌症治療中,CAR-T長期存在是一種優勢,因為它們提供了持久的療效)。也就是說,如果患者在接受傳統CAR-T治療後受傷, CAR-T細胞的長期存在可能會帶來安全風險。
LNP攜帶編碼FAP靶向CAR的mRNA,被注射到小鼠中後將mRNA遞送到T細胞中,導致瞬時FAP靶向 CAR表達。研究證實,FAP靶向CAR-T細胞能夠清除啟用的成纖維細胞,改善高血壓心臟損傷小鼠模型心臟纖維化。(來源:GRAPHIC: A. MASTIN/SCIENCE)
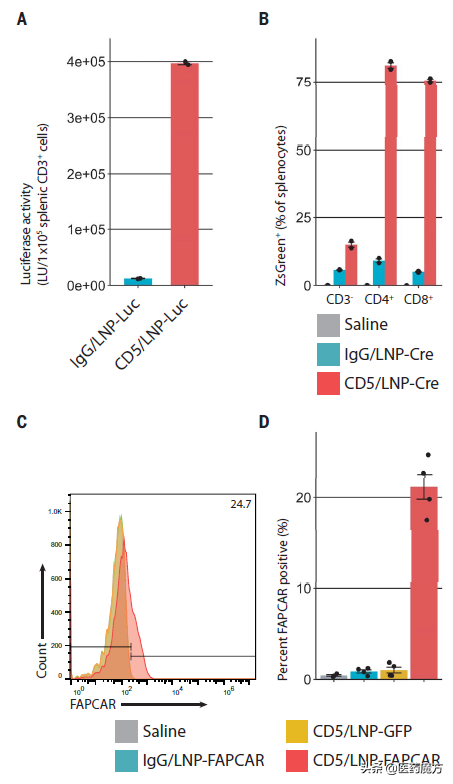
為了解決這一問題,在這項新研究中,科學家們設計了一種更暫時、更可控、程式更簡單的CAR-T細胞治療技術。具體來說,他們設計了一款mRNA,該mRNA編碼可與表達在成纖維細胞表面的成纖維細胞活化蛋白(FAP)結合的CAR;之後,他們將mRNA封裝在微小的氣泡樣脂質奈米顆粒(LNP)中,而LNP的表面又覆蓋著可以靶向T細胞的分子——靶向CD5的抗體(CD5天然地由T細胞和一小部分B細胞表達,並不是T細胞效應功能所必需的)。
CD5靶向LNPs在體內產生基於mRNA的FAP CAR-T細胞(來源:Science)
將封裝後的mRNA分子注射到小鼠體內後,mRNA分子被T細胞吸收,並作為成纖維細胞靶向受體的模板,有效地重程式設計了T細胞(產生了靶向FAP的CAR-T細胞),使其能夠攻擊啟用的成纖維細胞。這種技術的一個關鍵進步是,mRNA不能整合到T細胞DNA中,只能在T細胞記憶體活幾天,之後T細胞恢復正常,不再攻擊成纖維細胞。
更重要的是,科學家們發現,儘管mRNA存在時間很短,但在模擬心力衰竭的小鼠中注射這種mRNA成功地重程式設計了大量的小鼠T細胞,使得小鼠心臟纖維化顯著減少,大部分心臟功能恢復。此外,治療一週後,沒有證據表明小鼠體內仍有抗成纖維細胞(anti-fibroblast)T細胞活性(LNP注射24小時後,小鼠體內檢測到抗 FAP CAR-T;注射後7天內,這些CAR-T下降到無法檢測的水平)。
體內產生瞬時FAP CAR-T細胞可以改善損傷後的心臟功能(來源:Science)
據悉,研究人員正在繼續測試這種基於mRNA的瞬時CAR-T細胞技術,希望最終能開始臨床試驗。
“我們的這項研究最顯著的進步是,無需從患者體內分離出T細胞,直接在體內就能產生CAR-T細胞,這可能會帶來患者負擔得起的新型治療策略。同時,由於纖維化是許多嚴重疾病的基礎,包括心力衰竭、肝臟疾病和腎衰竭,因此,這種體內CAR-T療法可能具有可擴充套件的疾病治療用途。”共同領導該研究的Jonathan A. Epstein博士說道。
研究者們還表示,瞬時表達CAR的能力顯著提高了治療的安全性。Science雜誌針對該成果配發的一篇觀點文章稱,這項工作代表了將個性化免疫療法轉化為易獲取、可負擔得起的“現貨型”免疫療法的令人興奮的一步。
參考資料:
[1] JOEL G. RURIK et al. CAR T cells produced in vivo to treat cardiac injury. Science(2022).
[2] Vaccine-like mRNA injection can be used to make CAR T cells in the body(來源:Perelman School of Medicine at the University of Pennsylvania)
[3] mRNA shot spawns CAR-T cells in the body to repair heart disease damage(來源:FierceBiotech)
[4] T cells to fix a broken heart(來源:Science)