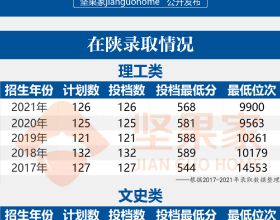
近日,發表於《scientific reports》的一篇文章展示了脂肪間充質幹細胞外泌體抑制耐藥三陰性乳腺癌生長的潛在治療作用。這項研究得出結論:間充質幹細胞外泌體是一種潛在的乳腺癌生物療法,可以作為其他標準治療的補充療法,以提供更好的療效,而不會出現不良反應。
目前,耐藥三陰性乳腺癌(TNBC)的治療包括新輔助化療,以及聯合選擇性PARP抑制劑和PDL-1抑制劑等。儘管如此,TNBC仍有可能會轉移和復發。因此,尋找替代策略對於治療侵襲性TNBC細胞至關重要。
在本研究中,研究人員開發了一種不同濃度的人脂肪間充質幹細胞外泌體制劑的加工方法,並對其分子組成進行了評價。在體外採用乳腺癌細胞株和裸鼠乳腺癌模型進行了實驗研究,發現外泌體具有劑量依賴性抑制三陰性乳腺癌生長的作用。
此外,為了進一步證明其療效,還評價了它在單藥治療和與紫杉醇聯合治療中的療效。該研究認為可考慮將外泌體制劑用作標準化療的附加療法。據瞭解,這是首次將間充質幹細胞外泌體作為一種潛在的治療TNBC的綜合研究。
間充質幹細胞外泌體:潛在的乳腺癌治療方案
在本研究中,研究人員首先製備出了冷凍乾燥後的幹細胞分泌物,透過物理和生化表徵方法發現其中富含蛋白質、脂質和 RNA 以及作為微量元素存在的 鈣,鐵,和磷。
在成功製備間充質幹細胞外泌體後,研究人員首先開展了體外試驗,即利用TNBC細胞株進行試驗。結果表明,當外泌體濃度超過20 mg/ml時,腫瘤細胞會被顯著殺死,但在該濃度下,對正常細胞沒有毒性。當濃度達到70 mg/ml時,可誘導90±10%的癌細胞凋亡。
圖片來自文獻[1]
在體外細胞試驗獲得成功後,研究人員又快馬加鞭地進行了動物試驗。研究人員將TNBC小鼠模型分為三組,其中一組接受濃度為50 mg/ml間充質幹細胞外泌體瘤內注射;一組接受100 mg/ml瘤內注射;另一組僅注射生理鹽水。每天注射50 mg/ml和100 mg/ml劑量的腫瘤後,腫瘤沒有生長,而注射生理鹽水後,腫瘤有明顯的生長。
圖片來自文獻[1]
對接受注射治療後的腫瘤標本進行蘇木精-伊紅染色,其中藍色染色的區域為腫瘤壞死區(箭頭所指區域)。從染色結果可以看出,接受生理鹽水注射後,看不到有藍色的腫瘤壞死區,視野中均為廣泛粉紅色染色的癌症組織。而外泌體注射治療後,可以看到箭頭指向的藍色腫瘤壞死區。
圖片來自文獻[1]
此外,該研究還進一步評估外泌體是否與常規化療藥物紫杉醇有協同作用,結果發現,其對紫杉醇耐藥的TNBCs生長有抑制作用。
幹細胞及其外泌體:癌症治療的新思路
近年來,幹細胞療法在再生醫學領域取得了許多突破性的進展,適應症不斷增加。其在癌症治療中的應用也在不斷探索中。幹細胞可以產生一些因子,如TNF-α相關的凋亡誘導配體(TRAIL)和IFN-β,這兩種因子都可以抑制癌症。
此外,幹細胞來源的外泌體也逐漸受到大家的重視。其不僅可以避免同種異體移植免疫排斥反應,還可以在實驗室的受控條件下提取,甚至可能進行工程化生產。因包含有益的抗癌因子,將來有可能成為一種更可靠的癌症生物治療方法。
從https://clinicaltrials.gov/網站我們發現目前臨床上有4000餘項與幹細胞相關的癌症治療登記在案,這也從側面反映出幹細胞對於癌症治療的巨大潛力。
一項研究發現[2],間充質幹細胞可以透過調節腫瘤微環境中的免疫成分來減緩癌症的進展。在結直腸癌大鼠模型中接受間充質幹細胞給藥,不僅能減少腫瘤的生長,還夠減少放療相關組織損傷。
此外,幹細胞用於癌症治療的另一途徑是透過分化為能夠攻擊癌細胞的細胞。這方面研究較多的是誘導多能幹細胞(iPSC),目前,iPSC已成功分化出具有攻擊癌細胞能力的NK細胞,NKT細胞等,相關實驗正在抓緊進行中。
總結
癌症治療仍然是目前醫學界的一大難題。近年來,大量新的治療方法正在研究中,其中包括幹細胞及其衍生物。從上述研究我們也可以看出,無論是單獨使用還是與標準療法聯合使用,幹細胞外泌體均顯示出強大的腫瘤抑制特性,這表明將來有可能是一種潛在的癌症治療方案。
不過,目前的研究結論仍然處在臨床前階段,未來還需要進行更深入的基礎研究以明確其作用機理以及進行更多的動物及臨床試驗以驗證其安全與有效性,來推動幹細胞及其外泌體在癌症生物療法領域的研究與應用。
參考文獻:
[1] Nadesh R, Menon KN, Biswas L, Mony U, Subramania Iyer K, Vijayaraghavan S, Nambiar A, Nair S. Adipose derived mesenchymal stem cell secretome formulation as a biotherapeutic to inhibit growth of drug resistant triple negative breast cancer. Sci Rep. 2021 Dec 6;11(1):23435.
https://pubmed.ncbi.nlm.nih.gov/34873206/
[2] François S, Usunier B, Forgue-Lafitte ME, L'Homme B, Benderitter M, Douay L, Gorin NC, Larsen AK, Chapel A. Mesenchymal Stem Cell Administration Attenuates Colon Cancer Progression by Modulating the Immune Component within the Colorectal Tumor Microenvironment. Stem Cells Transl Med. 2019 Mar;8(3):285-300.
https://pubmed.ncbi.nlm.nih.gov/30451398/