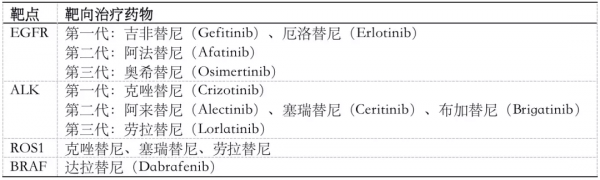
驅動基因的發現和靶向藥物的問世,使非小細胞肺癌(NSCLC)進入了精準醫學和個體化治療時代。十幾年來,隨著生物醫學不斷髮展,目前已經確定的非小細胞肺癌驅動基因包括EGFR、ALK、ROS1、BRAF等等。
針對這些驅動基因的小分子酪氨酸激酶抑制劑(TKI),也就是分子靶向治療藥物,已經從臨床試驗階段,逐步過渡到真實世界中來。這些藥物的“精準”特性,它們俱佳的療效和安全性,為晚期非小細胞肺癌患者帶來了新的治療選擇(表1)。
對一款藥物的評估,一般從療效和安全性兩個維度著手。更多人平時會更加關注藥物的抗腫瘤效果,特別是新的靶向治療藥物。其次才會關注這些靶向藥相對常見的毒性反應,如皮疹、胃腸反應、肝功能損害等等。而一些相對少見的安全性問題,比如靶向治療的心臟毒性,則往往容易被忽視。
臨床研究曾報道過的心臟毒性,包括心律失常、心力衰竭等,這些在進行治療過程中應引起我們的重視。此外,由於多數患者是老年人,其中一些病人本身存在心血管基礎疾病,那麼由這些藥物所帶來的心血管風險就更值得關注了。
近期,發表在《胸部腫瘤學雜誌》的一篇研究論文,利用WHO藥物不良反應資料庫VigiBase,對非小細胞肺癌常見靶向治療引起的心力衰竭、QT間期延長、室上性心動過速、室性心律失常等心臟毒性方面的資料,進行了總結報道。
ALK/ROS1抑制劑更容易引起心臟傳導阻滯
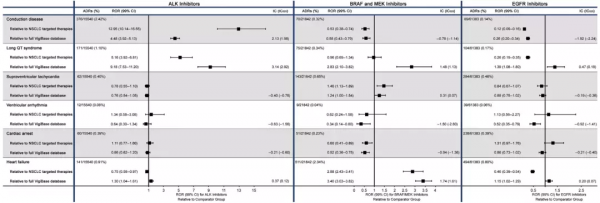
整體上來看,ALK/ROS1抑制劑較針對其他驅動基因(EGFR、BRAF和MEK)的靶向藥,發生心臟傳導性疾病(包括長QT綜合徵)的比例更高(圖1)。而ALK/ROS1抑制劑中,接受克唑替尼治療發生心臟傳導阻滯的比例高於其他藥物,其中位發生時間約為接受治療1個月時(30天),且9成為嚴重病例。
除ALK/ROS1-TKI外,其他抑制劑治療後發生長QT綜合徵的比例也高於整個資料庫平均水平(圖1)。
接受三代EGFR-TKI奧希替尼治療易發生多種心臟毒性事件
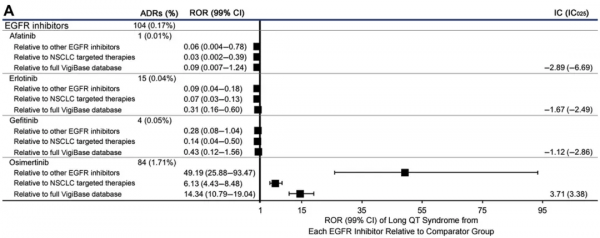
與其他EGFR抑制劑或其他驅動基因抑制劑相比,奧希替尼發生長QT綜合徵的比例明顯升高,一般在中位治療時間29天時發生(圖2)。此外,接受該藥治療後發生室上性心動過速的比例也較其他藥物高,發生中位發生時間為治療後21天,且9成病例為嚴重事件。發生心力衰竭的比例也較其他藥物明顯升高,中位發生時間在治療後約3個月(85天)。
BRAF和MEK抑制劑治療後發生心衰比例較高
除奧希替尼外,BRAF抑制劑達拉替尼治療後發生室上速的比例也較其他靶向治療藥物高,中位時間在治療後約2月(61.5天)。此外,達拉替尼和KRAS/MEK抑制劑曲美替尼(Trametinib)治療後較其他藥物更容易出現心力衰竭,中位發生時間分別為116天和87天(圖3)。
小結
ALK/ROS1抑制劑易引發心臟傳導阻滯,而EGFR抑制劑奧希替尼治療後容易出現多種心臟毒性事件,應引起我們的關注。其他藥物雖然導致心臟毒性事件發生的比例不及這些藥物高,但也有發生的風險。
所以,在靶向治療後的隨訪中,不要只關注療效,安全性同樣重要。而監測心臟毒性事件,最常見的檢查手段便是心電圖檢查,心電圖對發現各種心律失常也是極方便的方法,在每次隨訪時都不應忽略。此外,如果治療過程中出現呼吸困難、水腫等心力衰竭的臨床表現,也應及時就診,排除靶向治療因素的影響。
靶向治療過程中一定要遵循“安全第一”的原則,因為安全性是持久療效的重要保障。安全好療效佳,才是靶向治療真正的“雙豐收”。
參考文獻:Sarah Waliany, et al. Pharmacovigilance Analysis of Cardiac Toxicities Associated With Targeted Therapies for Metastatic NSCLC. Journal of Thoracic Oncology. 2021; 16(12): 2029-2039.