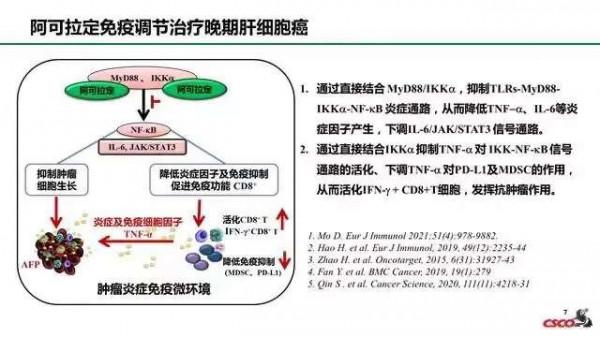
淫羊藿素軟膠囊(阿可拉定,Icaritin)於今年1月10日附條件獲批上市,用於不適合或患者拒絕接受標準治療,且既往未接受過全身系統性治療的、不可切除的肝細胞癌(HCC),患者外周血複合標誌物滿足以下檢測指標的至少兩項:AFP≥400 ng/mL;TNF-α
近年來,我國藥品監管改革不斷深化,藥品審評審批堅持“四個最嚴”原則,以確保上市產品的安全、有效、質量可控。CDE釋出的《以臨床價值為導向的抗腫瘤藥物臨床研發指導原則》對於抗腫瘤藥物的研發則提出了更高的要求,體現了科學評價臨床獲益的嶄新監管理念。
作為2022年CDE批准上市的首個國產創新藥,淫羊藿素軟膠囊不僅為中國晚期肝細胞癌治療提供了新的選擇,造福亟待更優治療藥物的患者,更是對傳統醫學創新模式及成果的肯定,臨床應用的市場空間增長潛力可期。
根據Globocan 2020資料,2020年我國肝癌新發病例數(41萬)和死亡病例數(39萬)分別約佔全球的45.6%和47.1%,均居世界之首。但與之相對,目前我國肝癌總體5年生存率僅為12.1%,晚期肝癌5年生存率不到5%,療效和生存預後亟待改善。淫羊藿素軟膠囊在臨床試驗中展現出的安全性和差異化治療優勢,有望為中國晚期肝細胞癌患者帶去更多的治療選擇。
華東醫藥表示將充分藉助自身商業化能力搭建打造淫羊藿素軟膠囊的銷售網路,加速藥品鋪開滿足患者需求。而華東醫藥也將在此次推廣中完善自身營銷網路的搭建,進一步提升商業化能力,為後續自身研發成果落地夯實基礎。此外在滿足合作協議相關條件下,中美華東擁有盛諾基研發出淫羊藿素新劑型、新制劑或與淫羊藿素軟膠囊有臨床替代作用的產品的市場推廣優先簽約權。
據瞭解,華東醫藥此次獲得淫羊藿素軟膠囊的推廣權益,不僅是公司多年來商業化資源和實力積澱的體現,也是公司創新轉型道路中一大重要佈局。公司聚焦抗腫瘤、內分泌、自身免疫三大重點領域,以未滿足臨床需求為導向佈局差異化市場。而淫羊藿素軟膠囊作為2022年獲批的第一個抗腫瘤創新藥,既有望進一步填補中國晚期肝癌患者的治療空白,也將完善華東醫藥在抗腫瘤創新藥領域商業化的“版圖”。
腫瘤領域是華東醫藥重點佈局的戰略領域,華東醫藥具備腫瘤用藥開發及產業化多年經驗,擁有多款已上市抗腫瘤產品。與ImmunoGen在抗體偶聯藥物(ADC)領域合作開發的IMGN853是全球首個針對葉酸受體α(FRα)陽性卵巢癌的ADC在研藥物,用於治療FRα高表達的鉑耐藥卵巢癌,在美國的關鍵註冊臨床試驗達到主要研究終點,其國際多中心Ⅲ期臨床研究和中國Ⅰ期臨床研究在中國均已完成首例受試者入組,正在按計劃順利推進;中美華東開發的治療晚期非小細胞肺癌的邁華替尼正在開展Ⅲ期臨床試驗,目前已完成全部受試者入組,預計2022年結束Ⅲ期臨床研究後開展上市申請工作。
華東醫藥董事長呂梁表示,“公司在醫藥行業具有完備的藥學服務體系及廣泛的市場資源。淫羊藿素軟膠囊作為國內首箇中藥創新抗腫瘤小分子免疫調節劑,為患者提供了新的治療選擇。此次與盛諾基就淫羊藿素軟膠囊的市場推廣進行合作,共同打造優勢互補、協同發展的共贏合作模式,將對雙方發展帶來積極影響。”
淫羊藿素差異化臨床價值突顯,中藥創新現代化發展成果可期
淫羊藿素軟膠囊作為我國擁有自主智慧財產權的原創天然口服小分子免疫調節劑,為全球first-in-class的一類原創新藥,先後獲得國家“十一五”、“十二五”、“十三五”等5項“重大新藥創制”科技重大專項的支援,並於2021年5月被納入到優先審評程式。
其核心成分為從傳統中藥材淫羊藿中提取純化的有效單體化合物淫羊藿素(Icaritin,又名“阿可拉定”),淫羊藿素可作用於免疫相關訊號通路,透過抗炎、調節機體免疫功能、改善腫瘤微環境等途徑發揮獨特的抗腫瘤效應,從現代醫學角度驗證了經典的“扶正治則”的腫瘤免疫治療理論。另外,其外周血標誌物富集人群的設計,更是開啟了探索中國晚期肝癌患者精準治療的新模式。該藥的獲批是基於Ⅲ期臨床研究的優秀資料,採用符合國際醫學標準的隨機對照試驗(RCT),經統計學分析證實淫羊藿素軟膠囊對於目標人群可帶來顯著生存獲益,且表現出更優的安全性。
據悉,淫羊藿素軟膠囊作為中藥創新藥的一大里程碑產品,經歷了十餘年科學嚴謹的臨床試驗和資料論證。於2010年開始至2020年的十年間,淫羊藿素先後完成5項臨床研究,包括臨床I期劑量探索(2010-2012)、臨床IIA期劑量及適應症拓展(2012-2014)、臨床II期單臂晚期肝細胞癌療效及安全性研究(2013-2015)及III期臨床驗證(2017-2020)包括淫羊藿素分別對比華蟾素一線治療晚期肝細胞癌。
長期以來,由於我國肝癌患者存在高度異質性,多數伴有乙型肝炎病毒(HBV)感染及免疫功能異常,基礎肝病背景複雜且嚴重,約70%的患者初診時已為中晚期,到目前為止,尚沒有明確的驅動基因作為晚期肝細胞癌標誌物用於臨床精準治療。
為此,在方案設計上,支援淫羊藿素軟膠囊獲批的III期臨床,採用的是複合生物標誌物及適應性富集設計,共納入283例未經一線系統性治療的晚期肝細胞癌患者,隨機分配至淫羊藿素軟膠囊治療組(n=141)或華蟾素對照組(n=142)。
去年2021年1月,淫羊藿素對照華蟾素一線治療晚期肝細胞癌患者的全國多中心註冊III期臨床試驗期中分析達到了預設的主要研究終點。同年5月,該產品上市申請獲得NMPA受理並擬納入優先審評,用於治療既往未接受過全身系統性治療的不可切除的肝細胞癌。
作為我國民族製藥企業自主研發的原創新藥,淫羊藿素軟膠囊研發成功為中醫藥的守正創新和傳承發展樹立了現代化典範,不僅為中國晚期肝細胞癌治療提供了新的選擇,造福亟待更優治療藥物的患者,更是對傳統醫學創新模式及成果的肯定。
(光明日報全媒體記者 王忠耀)