編者按:
史蒂芬·平克曾表示,“全基因組測序的價格將變得平易近人,人們必將開發出相應的軟體,持續不斷地提供個人醫療解讀。”關於人類基因與壽命的問題,平克在其《當下的啟蒙》一書中,也有詳細闡釋。
早在2014年,英國政府就推出了一個名叫“十萬基因組計劃”的醫學科研專案;2015年年初,奧巴馬宣佈了新的專案“精準醫療計劃”——希望首先招募100萬名甚至更多的志願者進行基因組測序;2015年3月,科技部召開國家首次精準醫學戰略專家會議,宣佈將在精準醫療領域投入600億元。
毫無疑問,精準醫療的應用依賴於廣泛的人群參與。但科學並不總是值得信賴的,也不總是平等地尊重所有參與者。對於某些型別資訊可用性的相關法律問題,都是具有挑戰性的問題。如果是你,你會主動提供自己的基因資料嗎?
我們中國有句古話叫作,“人吃五穀雜糧,哪有不生病的”,只要你得過病就一定吃過藥。可是,很少有人知道藥物到底是從哪來的。想要理解精準醫療,或許我們需要從理解藥物的概念開始。
在CHEERS2022湛廬年度大會上,北京航空航天大學生物學教授葉盛進行了有關藥物的分享。從藥物研發的歷史,再到對未來的藥物探索,在他看來,醫療的未來,是一個關於資料和AI的未來。
《藥物:資料與AI的未來》
演講:葉盛
北京航空航天大學生物學教授
科普中國形象大使
來源:CHEERS2022湛廬年度大會
01.
青黴素——人類史上最早的現代化小分子藥物
關於藥物研發的問題,最早可以追溯的案例應該是青黴素的研發。關於青黴素的研發,一共產生了3位諾貝爾獎得主。
其中第一位亞歷山大·弗萊明(Alexander Fleming),他所做的重要工作就是發現了青黴素。當時,他進行了一個很常規的細菌培養實驗,在實驗中,他就發現在培養皿中,有一塊區域不長細菌了。對於細菌培養來說,這是一個失敗的實驗,可是他並沒有把細菌培養皿直接扔到垃圾箱中,而是非常敏銳地意識到其中發生了什麼事情。他對這個問題堅持進行研究之後,最終發現原來是因為其中長了真菌,而真菌分泌的一種物質抑制了細菌的生長,這種物質就被命名為青黴素。
但是,為什麼諾獎又頒給了另外兩位科學家?這就告訴我們一個道理,從發現一個分子可以作為藥物使用,到真正能夠把分子變成一種上市銷售的藥物,這中間還有很大的鴻溝要去跨越。
那麼,恩斯特·柴恩(Ernst Chain)和霍華德·弗洛裡(Howard Florey)這兩位科學家他們所做的就是跨越鴻溝。當時,他們正在嘗試量產青黴素,把它變成一種可上市銷售的藥物。
第一個接受青黴素治療的人,是英國的一位警察,他因為傷口感染生命垂危,於是柴恩和弗洛裡把他們手中的青黴素用到警察身上,很快就緩解了他的傷口感染的問題。可是,最終這個警察還是死於傷口感染,為什麼呢?因為他們手中的青黴素全都用完了。
所以說,我們想量產青黴素的話,還有很多的技術問題需要解決。直到兩名科學家去到大洋彼岸的美國之後,在美國藥廠的幫助之下,才解決了青黴素的量產問題,使得我們擁有了人類歷史上第一種真正意義上的抗生素。同時,我認為這也是人類歷史上,第一種真正意義的現代化的小分子藥物。
那麼青黴素誕生之後呢?又過了10年左右,全世界的醫藥界就進入了一個抗生素大發現的時期,有點像是當時發現新大陸一樣。那麼,科學家要怎麼去找呢?他們到田間地頭,到臭水溝裡,到垃圾堆裡,哪髒就去哪找。因為在這樣的地方,生活著大量的微生物,其中說不準就有一種微生物能夠分泌某種化學物質,去抑制其他細菌的生長。而這種化學物質就有可能成為一種抗生素。
在抗生素大發現的時期,可以說是八仙過海,各顯神通。但是更準確的說法應該是瞎貓碰上死耗子,撞上就是撞上了,撞不上你也沒有別的辦法。直到後來,隨著生物學的發展,我們對於疾病有了更加理性客觀,在分子層面上的更加微觀的認知之後,藥物研發的情況才發生了轉變。
02.
格列衛——人類史上第一種理性設計的藥物
接下來,我們要看的這個案例,其中的藥物曾經出現在咱們國家一部非常成功的商業電影——《我不是藥神》裡。
在這個電影中,涉及這樣的一個群體,叫作慢性粒細胞性白血病患者群體。這個疾病為什麼會產生呢?就是因為製造白細胞的造血幹細胞不受限制地無限分裂,於是就生產出了很多的白細胞。當白細胞搶佔紅細胞的資源之後,人肯定就要生病了,甚至有可能危及生命。
那麼這個藥物是怎麼誕生的呢?在電影《我不是藥神》裡它的名字叫作格列寧,在現實生活中,它的名字叫作格列衛。而這個藥物來自瑞士的小製藥公司,當時這個公司想有針對性地去研究一種藥物,於是他們就找到了美國的生物學家布萊恩·德魯克(Brian Druker)來做這件事情。那麼要研究什麼疾病?德魯克覺得,最好研究的疾病就是慢性粒細胞性白血病,因為這個疾病是當時少數的,我們已經知道它背後的分子病理機制的一種疾病。
我們可以簡單地來看一下,為什麼造血幹細胞會無限地分裂?這是因為在造血幹細胞當中,9號染色體和22號染色體上發生了一個長臂的交換。這個交換髮生的兩個斷點的位置,恰好就是在兩個基因中間,那麼當這兩個長臂進行交換之後,就會產生兩個嵌合基因,其中稍短的那個被稱為費城染色體。在這個染色體上的基因叫作BCR-ABL基因,因為它的前一半是BCR基因的一半,而後一半是ABL基因的一半,而ABL基因恰好就是控制細胞分裂的一個開關。所謂開關,就得能開還能關,才叫開關。
ABL這個基因要怎麼關上呢?它所表達的一個蛋白質,會把自己的前半部分塞到自己的活性口袋中,把它堵死,這個基因對應的蛋白質就關閉了。可是,現在它的前半部分不但丟掉了,還換了一個跟它沒有任何關係的BCR。結果是什麼?是開關就永遠地打開了,於是造血幹細胞就會不斷地分裂,不斷地製造白細胞,最終就導致了白血病。
因為對這一套分子病理機制都非常地清楚,所以布萊恩就提出可以用 BCR-ABL蛋白質,去進行一個藥物篩選,並且他們真的成功了,他們真的找到了一種小分子,能夠很好地抑制蛋白質的功能,把開關給關上。
可是,這個小分子在後續的研究中出現了問題。首先,它表現出了非常大的細胞毒性,以及對動物個體的毒性,當時還無法解決它的毒性問題。其次,這個藥物的研發遇到了更大的困難,開發藥物的瑞士藥物公司,經歷了一系列的資產的兼併和重組,最終組成了一家藥物巨頭,名字就叫諾華。但是諾華的高層認為,這樣一個專案是沒有發展前途的,於是決定停止研發。
這個時候,布萊恩又一次站了出來,他親自與諾華的CEO進行溝通勸服。他說:“這個藥物是非常重要的,一旦我們研製成功,能夠救治成千上萬的白血病病人。”最終,這個專案得以繼續推進,並且造就了一代神藥格列衛。
在藥物研發歷史上,格列衛是有著重要地位的,可以說它是人類歷史上第一種靶向設計的藥物。因為它專門靶向BCR-ABL這樣一個蛋白,同時它也是人類歷史上第一種理性設計的藥物。你去品這句話——“第一種理性設計的藥物”,背後的潛臺詞是什麼?那就是在此之前的藥物都不是理性設計的,這其實是我們現在藥物研發的一大現狀。
理性設計的藥物研發思路,也是我們目前研究創新藥物的時候,主要走的一個思路。但是這條路並不好走,充滿著各種各樣的艱難險阻。其中最重要的一個問題就在於,我們通常不知道疾病背後所對應的分子層面的問題,到底是哪個基因出了問題,哪個蛋白質出了問題,這是很難去研究的。
03.
攻克血脂——用大資料探勘病因
那麼,今天的我們有沒有什麼新的辦法呢?在21世紀以來,隨著基因組測序技術的發展,我們的確有了新的方法,就是從大資料中去挖掘線索。
接下來我們要看的藥物,是一個和高血脂疾病有關係的藥物。美國的一位教授海倫•霍布斯(Helen Hobbs),她主要就是研究代謝疾病,特別是高血脂這個疾病的。他們在研究的過程中,其實已經知道這個疾病和某個基因有關,而這個基因就位於我們人類的1號染色體上,但是當時並不清楚,具體在1號染色體上的什麼位置,是什麼基因。
於是,海倫就主持了這樣一項工作,召集了幾千名高血脂的患者、健康人群,以及一種遺傳性的低血脂的病人,進行基因組的大資料測序。測序之後,把他們的1號染色體上的序列進行比較。最終,她成功地找到了一個有差異的基因,這個基因的名字就叫PCSK9。
那麼這個基因有什麼作用呢?其實當時還不知道。海倫又繼續進行了深入的研究,才發現這個基因跟我們回收血脂的能力有著很大的關係。通常來講,人體內肝臟細胞會從血液中回收血脂,回收過程是由在肝臟細胞表面的一個叫作LDLR的受體蛋白來介導的。在遺傳性的低血脂家族的病人體內,他們的PCSK9基因是一個殘缺的版本,導致他們的細胞不能生產正常的PCSK9。
海倫發現,PCSK9蛋白質的功能就是把細胞表面的那些血脂的受體LDLR給幹掉。這個家族的人因為沒有正常的PCSK9,所以他們的血脂受體進入細胞之後,又會重新跑到細胞表面,來回往復地迴圈利用。
結果就是,這些人的細胞表面上有很多的血脂受體,這些受體就能從血液中高效地把血脂給拉下來,所以他們永遠都是低血脂的。
海倫就想到,“如果能夠想辦法幹掉正常人體內的PCSK9蛋白,是不是就能解決高血脂的問題?”的確,她取得了成功,找到了一種抗體,這種抗體蛋白能夠很緊密地結合到PCSK9上,從而讓這樣的一個蛋白失去功能。結果患者體內有了這個藥物的作用之後,使得它的LDLR也不斷地從細胞裡邊回到細胞表面重複利用,最終就能夠高效地把血脂拉下來。
這個藥物已經成為一種成功的降血脂的藥物,它的研發過程不但是理性的,而且還得到了大資料的助力,讓我們能夠準確地找到跟疾病相關的靶基因、靶蛋白,讓我們的藥物設計可以有一個確定的方向去前進。
04.
打破壁壘——組學分析實現首例精準醫療
除了這樣的作用之外,像基因組這樣的大資料還能夠給我們的醫療帶來什麼樣的幫助呢?大家熟悉的可能是,我們能夠以很低廉的價格,在很短的時間內完成自己的基因組的資料測序。然後,我們就知道了自己的進化的來源等等很多有趣的資訊。
但是,比這些更重要的是,基因測序能夠在維護健康上真正帶給我們什麼幫助呢?在這裡,我也想跟大家分享一個案例,這個案例也是來自一個美國人,他的名字叫盧卡斯·沃特曼(Lukas Wartman)。只不過,這一次他不是什麼藥物或者療法的發明人,他是一種創新療法的受益者。
盧卡斯是一名白血病人,在很小的時候就查出患有白血病。但是當時他透過接受自己親兄弟的骨髓移植,治好了白血病,至少他自己以為治好了,他的醫生也以為治好了。可是等到他長大之後,來到西雅圖的華盛頓大學做一名博士後的時候,他的白血病再一次復發了,而且這一次發展得非常迅速,醫生採取了各種藥物治療的手段,都沒有取得好的效果。
可是盧卡斯非常幸運,因為他所在的研究組,恰好就是做癌症的組學研究的。他們這個研究組能夠透過像基因組、蛋白組、轉錄組等等這些在分子水平上的組學手段,去研究癌症的病因。於是,當時這個研究組就把手裡的研究工作都放下,把他們全部能夠集中的力量,都用來研究盧卡斯身上的健康細胞樣本和他身上的癌症細胞樣本之間的差異。
但是很遺憾,在基因組水平上,他們沒有發現什麼顯著的差異;或者說他們發現了太多的差異,但是不知道這些差異中,哪一個是跟他的疾病相關的。這是我們在進行組學研究,面對大量資料的時候,最常發生的一種狀況。
不過他們沒有放棄,接下來又進行了轉錄組水平的研究,也就是去分析正常細胞和癌細胞中,所有轉錄出來的信使RNA的水平的差異,結果同樣還是沒有找到病因。於是,他們繼續深入進行了蛋白質組的研究,去分析正常細胞和癌細胞中全部蛋白質水平上的差異。最終他們成功地找到了差異點,就是一個叫作FLT3的蛋白質,在他的癌細胞中有著異常高的表達量。
那問題來了,這樣的一個異常能夠導致癌症嗎?當時的學術界知道,這種異常會導致腎癌,但是從來沒有人知道這種問題會導致血癌。可是,盧卡斯的例子活生生地擺在這,告訴我們這個病因會導致血癌。這個時候,其實不一定就能夠挽救盧卡斯的生命,因為你知道了病因,也就是FLT3蛋白出了問題,但你不一定有相應的藥物能夠去解決這個問題。
應該說盧卡斯又一次受到了幸運女神的眷顧。因為當時在美國正好有一種靶向FLT3的腎癌藥物在進行臨床實驗,於是華盛頓大學的很多科學家就去跟美國的食品藥品監督管理局(FDA)進行溝通,來證明盧卡斯所患的這種疾病,與FLT3的異常升高有著緊密的關係,終於讓他用上了這種臨床實驗階段的藥物。很快,這種治療腎癌的藥物,就治好了他身上的血癌。
細想一下,你會發現,我們今天在談論癌症的時候,更多的是在談論某某器官、某某組織或者再精細一點,某某細胞。可在實際的學術研究中,當我們去討論一個癌症的時候,討論的是某某基因出了問題,某某蛋白質出了問題,這才是對於癌症的一種精準的認識。那麼,相應的這種認識只能夠從基因組測序、轉錄組測序以及蛋白組的分析中得出來。
應該說,盧卡斯·沃特曼是享受精準醫療的第一人。他的例子告訴我們,精準醫療是一種依賴於各種組學手段的、非常前沿的技術。
05.
大資料賦能,精準醫療讓醫生都成為華佗
不過,我想告訴大家的是,這種手段可能在咱們中國的古代就已經有它的雛形了,這就是對症下藥。這個故事來自誰呢?
它來自中國歷史上一位神醫華佗,在《三國志·華佗傳》中就記載了這樣一個故事:
當時,有兩位官吏患了同樣的病,他們的病症表現是一樣的,他們就去找華佗看病。結果,華佗給兩個人開了不同的藥,兩人就很疑惑地說,我們倆的病一樣,為什麼要開不同的藥?華佗告訴他們說,因為他們兩個的病因是不一樣的,所以要用不同的藥。最後,這兩個官吏回到家中,服用不同的藥之後各自治好了病,這就是對症下藥的故事。
在這件事中,最偉大的是誰?是華佗,因為他有著非常高超的醫術,能夠透過表面的病症看到疾病的本質。但是,今天能做到這一點的人肯定是少數,那麼精準醫療要怎麼做才能實現呢?
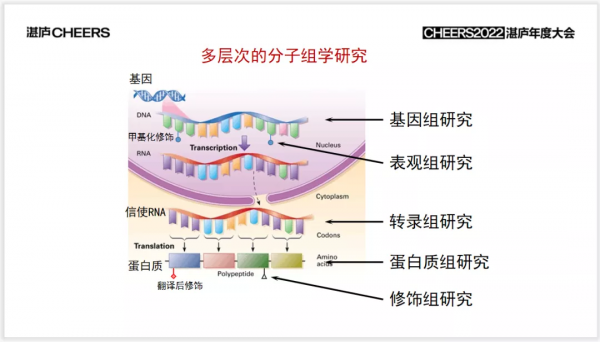
那就是透過生物學技術的手段,在基因組層次上、表觀組層次上、轉錄組層次上、蛋白組層次上,甚至是修飾組層次上,在分子水平上,對一個人做出精準的診斷,然後在這個基礎上,做出一個個性化的、定製化的醫療方案,這就是精準醫療。我們希望,透過技術能夠讓每位醫生都變成華佗。
當然了,這是一個比較遙遠的理想,我們目前還在努力讓這種技術變得更加的便宜,能夠變得更加的便捷,讓所有人都有機會享用到它。
06.
AI技術創新研發,讓病者皆得其藥
那麼,要說除了大資料之外,還有什麼技術能夠給我們的藥物研發帶來幫助呢?那就是近年來發展得非常快的 AI技術了。我們前面提到了,在你有了一種可能的藥物分子之後,在你真正把它作為一種藥物產品開發出來之前,中間還有很多的鴻溝要去跨越。現在,AI技術在這些鴻溝的跨越上,就能夠給我們很大的助力。除了助力跨越這些技術上的鴻溝之外, AI技術還體現出了更加強大的能力。
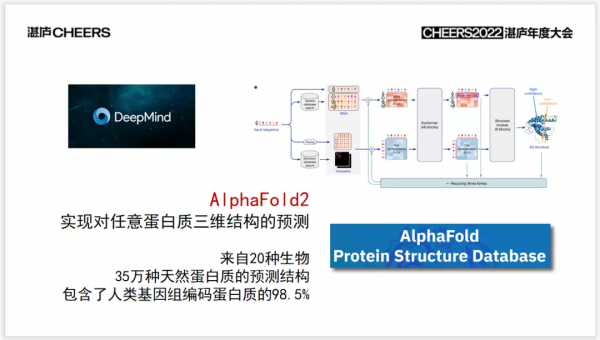
比如說,大家可能聽說過一家公司DeepMind,這家公司曾經開發了一個程式——AlphaGo,一種下圍棋的人工智慧演算法,最終擊敗了所有的人類高手。至少證明了在圍棋這件事上,計算機也是可以勝過人類的。在此之後, Deep Mind團隊就把精力轉到了其他的方向上。近幾年來,他們在嘗試利用人工智慧技術,來解決蛋白質相關的一些生物學的問題。
在今年夏天的時候,他們發表的學術文章上公開了一個新的程式,叫作AlphaFold,展示了它的一個技術的路線圖。這個程式的作用就是進行蛋白質的三維結構的預測,他們利用這樣的一個人工智慧演算法,目前已經完成了20種生物,多達35萬種蛋白質的精確的三維結構預測。其中就覆蓋了人類的兩萬多條基因所編碼的蛋白質中98.5%的蛋白。可以說,他們已經在結構預測這件事上,完成了人類的一個蛋白質組學的研究,這件事無疑會對藥物未來的研發有很大幫助。
他們也沒有閒著,就在前幾天,他們剛剛發表了最新的研究成果,這次他們提出的一個演算法命名為DeepMind 2021。這個演算法能夠解決分子的一個電子密度泛函的問題。這個問題聽起來很深奧,它能夠幫助我們去解決小分子的設計問題。我們知道,今天大部分的藥物其實都是小分子的,我們已經能夠用蛋白質結構等等的這些生物學資料去訓練AI。
那麼,未來AI能做些什麼呢?實際上就在我自己的研究組裡,我們正在嘗試利用AI的技術去做蛋白質的設計,反過來去完成一個非天然蛋白的設計,而非天然蛋白就可以當作藥物來使用。我想,這就是藥物的未來之一。
在前面的內容中,我們提到了神醫華佗,實際上歷史學界對於到底存不存在這樣一個人物是有爭議的。不過,有一位中醫歷史上非常著名的人物是確實存在的,就是藥王孫思邈。孫思邈有一部非常重要的著作,叫作《千金要方》,在這個書裡,他就曾經提出過一個理想。這個理想是什麼呢?
希望將來病人無論貴賤貧富,都能夠得到自己應該得到的醫治。
那麼,我想今天這個理想基本上算是實現了,我們大家都能夠獲得自己想要獲得的醫療資源。但是,由於我們對於疾病的認識還遠遠不夠,所以,絕大多數疾病仍舊處在無藥可用的狀態。我相信,所謂藥物的未來就是能夠在大資料與AI的賦能之下,去實現藥物的一個快速研發,為所有人提供一個定製化的精準醫療,最終能夠做到“病者皆得其藥”。
好的,謝謝大家!