29 歲的湖南青年梁世康,雖然還是博後,卻已經成為Nature正刊論文的通訊作者。
他本科就讀於復旦大學,期間參加復旦和伯明翰大學的“2+2”聯合培養,獲一等榮譽學位畢業後,赴劍橋大學攻讀博士學位,師從生物化學系教授湯姆·布倫德爾爵士(Sir Tom Blundell)。博士畢業以來,一直在該課題組留任博後。
布倫德爾爵士是全球結構生物學、蛋白晶體學的先驅之一,亦是最早運用蛋白結構和生物資訊分析來指導小分子藥物開發設計和最佳化的結構生物學家。他於 1984 年當選英國皇家學會會員,1996 年到 2009 年擔任劍橋大學生物化學系主任,曾任英國科學委員會主席。

圖 | 左為湯姆·布倫德爾爵士(Sir Tom Blundell);右為梁世康(來源:梁世康)
2022 年 1 月 5 日,由梁世康和布倫德爾擔任共同通訊作者的論文,以題為《DNA修復蛋白 DNA-PKcs 抑制劑調控的結構見解》(Structural insights into inhibitor regulation of the DNA repair protein DNA-PKcs)發表在 Nature[1]。
梁世康指出,過去二十年以來學術界和製藥界一直未能很清楚瞭解的小分子抑制劑和人體 DNA 損傷修復核心蛋白激酶(DNA-PKcs)的作用機理。
論文揭示了相關機理分子水平的細節,這為相關抗癌藥物的設計提供了明確方向指導,也揭示了配體結合對於 DNA-PKcs 後續催化反應的促進效果,同時在基於結構的藥物開發和設計上再次展現出冷凍電鏡的重要潛力。
揭開二十年來“不明”機理
DNA 依賴蛋白激酶催化亞基(DNA-PKcs)在非同源端連線中起著重要作用,這是人類檢測和修復 DNA 雙鏈斷裂(DSBs)的兩種主要途徑之一。
DNA-PKcs 在修復病理性 DSBs 中具有重要作用,結合 DSBs 誘導的放療和化療,DNA-PKcs 抑制劑已成為很有吸引力的癌症治療藥物。目前,已開發的許多 DNA-PKcs 選擇性抑制劑在治療各種癌症方面具有潛力。
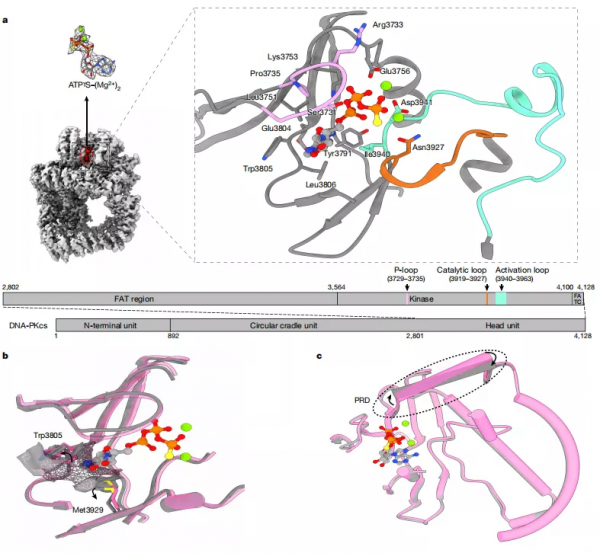
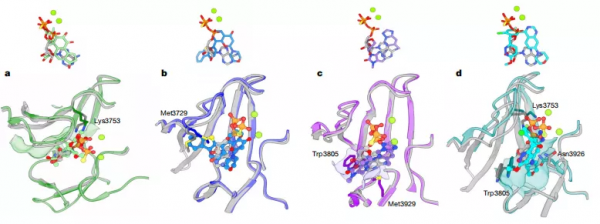
該研究報道了從 HeLa 細胞核提取物中純化的天然人類 DNA-PKcs 與不同配體複合物的冷凍電子顯微鏡(cryo-EM)結構。這些配體包括腺苷-5'-(-硫代)-三磷酸鹽(ATPγS)和四種抑制劑(渥曼青黴素、NU7441、AZD7648 和 M3814),其中包括正在進行臨床 I、II 試驗的候選藥物。
而該結構揭示了配體在 ATP 位點結合的分子細節,並提供了對競爭抑制劑的作用模式和特性的見解。值得注意的是,配體的結合導致 PIKK 調控域(PRD)發生移動,揭示了 p 環和 PRD 構象之間的連線。
電泳遷移率測定和 cryo-EM 對 DNA 依賴蛋白激酶全酶的研究進一步表明,配體結合對全酶複合物的組裝沒有負面的變構或抑制作用,抑制劑透過與 ATP 直接競爭發揮作用。
作為細胞訊號傳導的主要調控者, 蛋白激酶的相關製藥在各個疾病領域尤其是癌症上,展現出驚人療效和巨大潛力。
DNA-PKcs 作為人體 DNA 損傷反應與修復的核心激酶,更是延緩和治療癌症的重要靶點。抑制 DNA-PKcs 活性可以阻斷相關 DNA 修復通路,加速紊亂癌細胞的基因組來殺死癌細胞。
此外,對於透過破壞癌細胞基因組穩定來殺死癌細胞的治療方式、比如放療和化療來說,抑制 DNA-PKcs 活性還能加強治療效果。
因此,學術界和製藥界一直在針對 DNA-PKcs 的抑制劑進行研發。尤其是製藥公司透過高通量篩選和藥物分子最佳化設計,開發出了第一代和第二代特異性抑制劑,並已有數個小分子藥物進入臨床 I、II 期試驗。
然而,因為蛋白自身大小、靈活度、穩定性和取向偏好等因素,在晶體時代和自冷凍電鏡革命以來,其相關結構研究進展緩慢,一直無法獲得蛋白和抑制劑相互作用的高解析度結構資訊。
基於該問題,梁世康運用冷凍電鏡,在新增自制單層氧化石墨烯薄膜作為基底和最佳化實驗條件之後,獲得了穩定的 DNA-PKcs/抑制劑複合物,並解析出了相關高解析度結構。
透過天然配體/廣譜抑制劑/第一、二代特異性抑制劑,與 DNA-PKcs 相互作用機理的縱向比較,結合其同源激酶家族成員、與配體和抑制劑相互作用機理的橫向比較,他們首次得以從分子層面闡釋 DNA-PKcs 抑制劑特異性差異的原因,併為新一代抑制劑的設計和最佳化提供了指導思路。
不僅如此,各種配體在同一結合位點的不同作用方式,也揭示出 DNA-PKcs 催化中心內部不同結構域之間的協同運動,展現出配體對底物結合的促進作用,這也幫助梁世康進一步瞭解相關催化機理。
總的來說,該研究中描述的結構將極大地幫助未來靶向 DNA-PKcs 的合理藥物設計,展示 cryo-EM 在結構引導的大型和挑戰性目標藥物開發中的潛力。
“最難忘解出 DNA-PKcs/NU7441 複合物結構那天晚上”
選擇和努力一樣重要,這同樣適用於科研圈。正因為梁世康選擇了布倫德爾,布倫德爾選擇了他,才有了今天的成果。
多年以來,布倫德爾教授持續關注研究人體 DNA 雙鏈斷裂修復的相關結構機理。2001 年,該實驗室開始 DNA-PKcs 相關的結構研究,2009 年率先得到 DNA-PKcs 的晶體,並解析出 6.6Å 的蛋白結構 [2]。
2017 年,在最佳化結晶條件和使用硒代蛋氨酸標記的基礎上,該團隊成功解析出 4.3Å 的晶體結構,成功提出第一個 DNA-PKcs 的原子結構模型[3]。
梁世康回憶稱,剛進實驗室讀博時,他的課題是運用晶體衍射的方法,來研究包括蛋白-蛋白和蛋白-配體在內的、與 DNA-PKcs 相關的蛋白複合物。
但是由於相關蛋白表達難、無序度高、穩定性低、提純複雜以及產量低,結晶難等一系列挑戰因素,讓其早期研究進展非常緩慢。
他說:“有時做了整整一週的蛋白純化,卻只能拿到幾百微克的蛋白樣品,只夠測試和最佳化很少的實驗條件。”
在不停做實驗的同時,他也不斷地跟導師、實驗室前輩和同事探討,並透過閱讀文獻不斷“充電”。在導師的信任和支援下,他積極拓展研究方法,開始運用冷凍電鏡單顆粒技術。
其表示:“讓我很難忘的,是解出 DNA-PKcs/NU7441 複合物結構也是第一個 DNA-PKcs / 配體複合物結構的那天晚上。”
不同於多蛋白組分複合物可在電鏡下、或二維投影裡直接看出結合伴侶是否存在,因為配體是小分子,在得到三維結構之前,很難判斷其是否作用在結合位點上。
由於之前不少嘗試都不盡如人意,在計算機上分析這套資料時,梁世康已經開始思考接下來可行的最佳化實驗和具體安排。
而在得到三維結構之後,當他在結合位點裡清楚看到來自配體的訊號的那一刻,他十分欣喜,這意味著能以此為基礎,來研究其他特異性不同的抑制劑和 DNA-PKcs 的相互作用。
可指導針對 DNA-PKcs 的小分子激酶抑制劑的設計
對於該研究的應用價值,他說:“最直接、最明顯快速的應用前景,在於可指導新一代針對 DNA-PKcs 的小分子激酶抑制劑的設計。”
在獲悉抑制劑和蛋白的作用機理,也透過一系列橫向與縱向對比,弄清楚抑制劑特異性的來源之後,即可結合生物資訊分析藥物靶點的結構特性,去設計特異性更好、與結合位點更適配的小分子抑制劑。
說到這裡他表示:“我們發表並公開了所有相關結構,這樣不僅是我們課題組,全世界其他研究小組和製藥公司都可使用此次釋出的結構資訊,來最佳化和指導已有小分子藥物。雖然離讓廣大病患使用到具體藥物還有很長一段路,但這無疑可以加速相關抗癌藥物的研發,助力未來造福患者。”
不僅如此,該研究也是一個很好的概念驗證,對於 DNA-PKcs 這種頗具挑戰性的蛋白來說,證明了運用冷凍電鏡來做基於結構的藥物設計是可行的。
除傳統小分子激酶抑制劑和藥物靶點之外,藉助該研究也可關注其他型別藥物 ,比如蛋白降解靶向嵌合體、以及多肽和其他結合位點。
相比目前已成熟的傳統激酶抑制劑研究,儘管這些發展和應用更加耗時耗力,成本也相對高昂,但是藥物發展充滿各種可能性,值得積極嘗試。
接下來,梁世康也會牽手合作團隊,探究新一代抑制劑的最佳化,以追求更好的特異性和結合強度,並將繼續深耕人體 DNA 損傷反應與修復以及相關新型藥物分子的開發。
-End-
參考:
1、Liang, S. et al. Structural insights into inhibitor regulation of the DNA repair protein DNA-PKcs. Nature (2022) DOI: 10.1038/s41586-021-04274-9
2、Sibanda, B. L., Chirgadze, D. Y., & Blundell, T. L. Crystal structure of DNA-PKcs reveals a large open-ring cradle comprised of HEAT repeats." Nature 463.7277 (2010): 118-121.
3、Sibanda, B. L., Chirgadze, D. Y., Ascher, D. B., & Blundell, T. L. DNA-PKcs structure suggests an allosteric mechanism modulating DNA double-strand break repair. Science (2017):355(6324), 520-524.