整理:腫瘤資訊
來源:腫瘤資訊
王紅霞
上海市第一人民醫院腫瘤中心中心主任,主任醫師,教授,博導。從事腫瘤臨床工作20多年,主要研究方向為乳腺癌和胰腺癌的研究與精準診治。擅長乳腺癌、前列腺癌、膽胰腫瘤及神經內分泌腫瘤等綜合性個體化診治。
新輔助人群的選擇
對於可手術乳腺癌患者是否進行新輔助治療的決策制定取決於醫生與患者透過新輔助治療想達到什麼樣的目的。手術降期?保乳?術前藥敏?還是彌散腫瘤細胞殺滅,降低手術播散機率?從目標和臨床需求出發,現有臨床實踐認為對於可手術乳腺癌患者適合進行新輔助的人群為ⅡA、ⅡB或ⅢA期患者。但同時還要考慮腫瘤的生物學特性,目前已有多項循證證據顯示,乳腺癌的分子亞型在一定程度上決定了病理學完全緩解(pathological complete response,pCR)的獲得比例,尤其在一些高度侵襲性的乳腺癌亞型中如TNBC、HER2陽性更容易從新輔助治療中獲益[1]。非常年輕的女性新輔助治療後更可能獲得pCR, 2012年聖安東尼奧乳腺癌會議(SABCS 2012)報告的一項研究表明,35歲或以下女性乳腺癌患者接受新輔助治療後得到病理完全緩解的機率高於年長患者,年齡是pCR的獨立預測因素[2]。
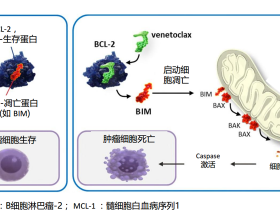
除前述新輔助治療的目標外,如今我們更加關注這部分患者pCR的主要原因在於達到pCR患者的良好預後。早先NSABP B18與B27兩個大型臨床研究表明:術前新輔助治療獲得pCR是生存的重要指標[3]。2012年5 月美國 FDA 公佈早期、高危乳腺癌新輔助治療藥物加速審批指南草案, 使研發者得以用pCR作為替代終點,有助於在早期乳腺癌藥物研發中節省時間和費用[4]。2014年《柳葉刀》(Lancet) 發表一項大型薈萃分析的資料,納入12 個臨床試驗、12993例乳腺癌患者,再次證明pCR 可以預測遠期生存(EFS/OS)[1]。但是pCR是否一定能轉換成長期獲益,也是值得思考的,比如NeoALTTO研究顯示新輔助抗HER2聯合化療後pCR患者的EFS和OS顯著優於未達到pCR患者,聯合ALTTO研究看就認為不能將pCR轉變為生存獲益[5, 6],這可能也與研究模式、入組患者差異性有關。
如何看待新輔助的治療方案
自曲妥珠單抗1998年批准臨床應用以來,對於HER2陽性乳腺癌患者的抗HER2治療已經是標準治療方案,無論在輔助治療、晚期姑息性治療還是新輔助治療領域。抗HER2治療與新輔助化療方案的聯合,原則上可應用於輔助治療的方案皆可應用於新輔助治療,但考慮到新輔助治療的特殊性—腫瘤快速退縮的療效評估與對pCR的提高,在新輔助治療中我們傾向於一些更強有力的方案如蒽環類與紫杉類的序貫或聯合應用,或劑量密集方案的使用,比如PREPARE及SICOG9908試驗顯示紫杉醇劑量密集組的pCR 率明顯要高於傳統3 周化療組[7]。
抗HER2治療在新輔助中的應用已經毋庸置疑,尤其對於高復發風險的患者。NOAH研究顯示對於HER2陽性乳腺癌,相比於單純化療,聯合曲妥珠單抗治療能夠使bpCR從22% 提高到43%,且3年無事件生存率有顯著改善,提示在化療的基礎上加上抗HER2治療不僅能顯著提高pCR,且能改善患者的遠期預後[8]。由於新輔助治療相比輔助治療可以快速獲得療效的臨床判定,因此目前在新藥研發程序上也快於輔助治療,很多的靶向治療、包括雙靶治療等也是更先獲得新輔助療效資料。Ⅱ期的NeoSphere研究顯示多西他賽+曲妥珠單抗聯合帕妥珠單抗組患者獲得顯著更高的pCR率[9];Ⅱ期 TRYPHAENA研究也證實曲妥珠單抗+帕妥珠單抗+化療是目前優選治療方案[10]。2013年9月30日FDA批准了帕妥珠單抗+曲妥珠單抗聯合化療藥物在新輔助治療中的應用,用於T>2 cm或有LN+患者,其中TCHP方案是一個不錯的臨床選擇,保障療效的同時心臟毒副反應較小。
新輔助療效的判斷
新輔助治療療效評估至關重要,目前臨床上的療效評估還是以影像學檢查作為金標準,PET-CT等其他檢查也常規進入我們療效評估的視野,關於18F-FDG測定來預測pCR目前研究已有很多探索,原發腫瘤的18F-FDG -PET標準攝取值改變(ΔSUV)與治療結束後的pCR相關表明PET/CT能成為預測pCR的有效方法[11],然而隨著現代腫瘤診療進入精準醫學的時代,我們會發現現有的這些基於影像學的評估手段遠遠不能滿足我們的臨床需要。關於CTCs、DTCs等為代表的液體活檢技術在預測腫瘤進展動態變化及早期亞臨床轉移上的優勢,值得我們更多的關注,尤其對於腫瘤異質性的探索,對於一些高轉移潛能細胞的檢測。我院腫瘤中心團隊採用多種技術手段包括血液迴圈腫瘤細胞CTCs/骨髓彌散腫瘤細胞DTCs分離與培養、相關腫瘤細胞系及腫瘤動物模型的建立、CTCs/DTCs單細胞全基因組擴增與NGS測序等,在乳腺癌患者體內精確鎖定了腫瘤遠處臟器轉移過程中起主導作用的腫瘤細胞亞型細胞– EpCAM陽性的異倍體CTCs與DTCs,乳腺癌患者骨髓中檢出EpCAM+異倍體小細胞DTCs可準確預測患者6個月的較差預後,如果患者體內EpCAM+異倍體小細胞DTCs佔DTCs總數 ≥20%,預示著患者總生存率明顯降低,該項研究成果剛剛發表在《科學•進展》(Science Advances, AAAS)[12],但是這一類分子檢測對技術要求較高,目前還不能大範圍推廣,如何進一步推廣於臨床應用還有一段很長的路要走。
HER2陽性乳腺癌新輔助雙靶方案治療達到pCR患者,後續的輔助治療應如何選擇
如我前面所談到的,現在越來越強調pCR與否對於後續治療的指導意義。但乳腺癌是一種全身性的、異質性疾病,除病理學pCR評估之外,未來的研究中我前面提到的CTCs/DTCs的殘留多少也有可能是需要納入到亞組分析考量的一個內容,換句話說就是達到了pCR這部分患者的分子異質性或風險需要進一步評估,我們期待更精準的液體活檢或分子指標來進一步指導臨床治療。
對於新輔助non-pCR的患者,後續輔助治療應該給予怎樣的方案
新輔助治療的另一個重要意義在於透過早期藥敏對後續治療的指引,包括對輔助或復發後遠期用藥的指導。CREATE-X研究所取得的DFS和OS的陽性結果,正是說明了藥敏指導下的後續治療能夠為OS帶來獲益[13]。此外,既往研究顯示新輔助治療後沒有達到pCR的這部分患者預後相對更差,可能是由於新輔助治療把這一部分更高危的患者篩選出來,因此我個人觀點認為對於這一部分患者在輔助階段可能還有待加強。但是如何加強?化療加強還是靶向加強?療程以多長為宜?這些還有待進一步探討。Katherine研究入組1486例新輔助後non-pCR的患者,1:1隨機分組進入曲妥珠單抗組或T-DM1組,這個設計完全符合我們臨床治療需求,結果也是比較符合預期的,後續T-DM1強化治療組相比曲妥珠單抗組,3年iDFS絕對獲益提高了11.3%[14],是目前共識和指南推薦優選方案。