1.簡介
1.1. AlkB 核酸脫甲基酶家族
所有生物體的 DNA 和 RNA 都經歷了多種化學修飾。這些修飾中的一些是導致突變的破壞性病變,一些是酶催化的,在一系列生物過程中發揮關鍵作用,包括表觀遺傳機制、基因表達和 RNA 功能的調節。迄今為止,已報道了 160 多種不同的核酸鹼基修飾,其中最簡單且目前研究最深入的修飾是N-甲基化,其中一個或多個甲基直接新增到氮核酸鹼基的原子。透過這種巧妙的機制,大自然很容易生成 N-甲基化鹼基的庫,從而迅速擴充套件四種經典 DNA 和 RNA 鹼基的結構和功能多樣性。近年來,越來越清楚的是,N-甲基化鹼基存在於三個領域的生命中(three domains of life)。它非常普遍,佔RNA中所有表觀遺傳修飾的60% 以上。事實上,除了鳥嘌呤N3位置外,所有已知核鹼基氮位置都能夠被甲基化。新發現的證據表明,這些鹼基的甲基化狀態不是靜態的,而是由DNA/RNA甲基轉移酶和脫甲基酶之間複雜的相互作用動態調節的,它們分別從這些鹼基上連續寫入和擦除甲基修飾。一類重要的核酸脫甲基酶是鐵(II)和2-酮戊二酸(2OG)依賴性加氧酶的AlkB家族,包括大腸桿菌AlkB、九個人類同源物、ALKBH1-8、和脂肪量和肥胖相關蛋白 (FTO)(圖 1)。
圖1. AlkB 亞家族的域架構。DSBH 周圍的結構元件對 AlkB 同源物的底物特異性和生物學功能有顯著貢獻。值得注意的是,NRL 是 AlkB 亞家族的一個獨特特徵,在其他 Fe(II)/2OG 依賴性加氧酶中不存在;因此,該域有可能被利用來實現對 AlkB 脫甲基酶的選擇性靶向,而不是其他 Fe(II)/2OG 依賴性加氧酶。(圖片來源:J. Med. Chem.)
2. AlkB脫甲基酶在生物學和人類疾病中的作用
鑑定各種 AlkB 脫甲基酶的底物是全面瞭解這些迷人酶的生物學功能的重要一步。目前有許多優秀的評論詳細討論了它們的表觀遺傳機制和治療潛力。越來越清楚的是,AlkB 亞家族與一系列人類疾病有關。特別是FTO與肥胖、II型糖尿病、阿爾茨海默病、和非酒精性脂肪性肝炎(NASH)、密切相關,而ALKBH1 與胃癌有關和膠質母細胞瘤。新出現的證據進一步表明ALKBH2和ALKBH3在體內都起到DNA修復酶的作用,它們的過度表達可能會促進人類的腫瘤發生。例如,ALKBH2在膀胱癌中高表達,而ALKBH3,也稱為前列腺癌抗原 1 (PCA-1),有助於胰腺癌、非小細胞肺癌和腎細胞癌,目前正在靶向治療前列腺癌。還有證據表明ALKBH5參與精子發生和結腸癌。最近,據報道ALKBH7 和 ALKBH8分別與前列腺癌和膀胱癌有關,並且可能是治療這些癌症的潛在靶點。
AlkB去甲基化酶與多種人類疾病之間的強大生理聯絡激發了學術界和製藥業的濃厚興趣,為這些酶開發小分子抑制劑以促進其結構、機制和功能研究,以期更長遠地驗證其治療潛力。過去20年來在提高AlkB去甲基化酶抑制劑的效力和選擇性方面取得的顯著進展。Esther C. Y. Woon發表於J. Med. Chem.的綜述文章討論了大多數(如果不是全部)報告抑制劑的合理設計、它們的結合模式、選擇性、細胞活性和治療機會。該文章進一步討論了 AlkB 脫甲基酶的亞家族特異性結構元件,並提出了實現亞家族選擇性的潛在策略。我們希望這項工作將刺激對這些醫學上重要的酶的進一步抑制研究,並推動新型表觀遺傳療法的發展。
3. 用於合理藥物設計的 AlkB 脫甲基酶的結構比較
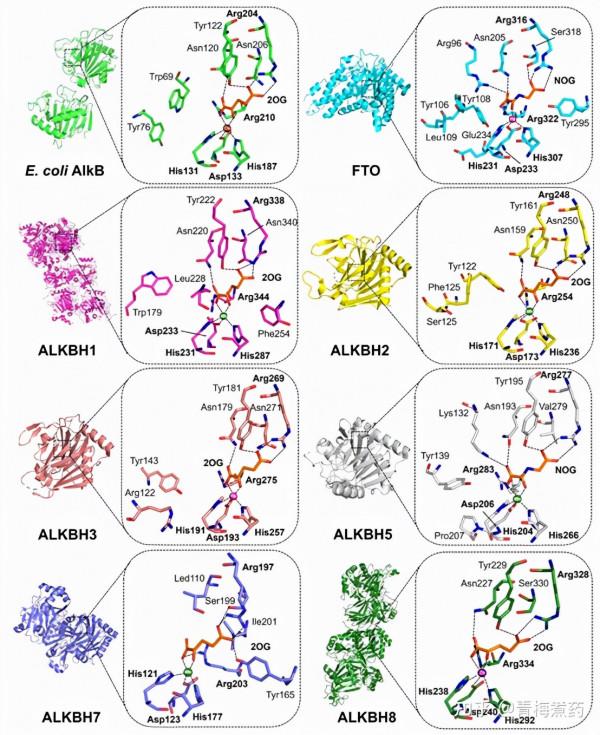
迄今為止,已經報道了超過 100 種 AlkB 亞家族成員的晶體結構,為它們的配體/底物識別和催化機制提供了豐富的結構見解。豐富的結構資訊進一步使基於結構和計算輔助的抑制劑設計成為可能(有關優秀評論,請參見參考文獻 (68) 和 (69))。迄今為止,除ALKBH4和ALKBH6外,所有AlkB亞家族成員都已在結構上進行了表徵。圖2 提供了與 2OG 共底物或其催化惰性類似物 NOG(N-草醯甘氨酸)複合的 AlkB 脫甲基酶的晶體結構的代表性檢視。
圖2. 與2OG共底物或其催化惰性類似物 NOG(N-草醯甘氨酸)複合的 AlkB 脫甲基酶的晶體結構的代表性檢視(圖片來源:J. Med. Chem.)
4. AlkB 亞家族的氧化去甲基化
所有 AlkB 亞家族成員都包含一個 DSBH 催化結構域,該結構域能夠使一系列底物氧化去甲基化。 Hausinger、Schofield、Krebs、He等小組和許多其他人的開創性研究為AlkB脫甲基酶和其他 Fe(II)/2OG 依賴性加氧酶的催化機制提供了廣泛的晶體學、動力學、光譜學和生化證據。簡而言之,目前的共識是核酸去甲基化透過有序的順序機制進行,如圖 1C 所示。它可能始於活性位點 Fe(II) 與 His-Asp-His 三聯體和三個水分子的配位(酶靜止狀態 A;圖 1C)。 (i) 2OG 共底物然後以雙齒方式螯合到 Fe(II),取代兩個金屬結合的水分子,這些水分子被轉移到近端組氨酸和天冬氨酸殘基,形成 Fe(II)-2OG 複合物 B。 (ii) ) 隨後甲基化底物與底物結合位點(靠近 Fe(II) 中心)的結合減弱了剩餘水分子與 Fe(II) 的結合並取代了它,(iii) 建立了一個位點用於結合雙氧分子以形成 Fe(III)-超氧中間體 C。 (iv) 這種中間體非常不穩定。它迅速坍塌形成 Fe(IV)-雙環物質 D,進而觸發 (v) 2OG 的氧化脫羧生成琥珀酸鹽和高反應性的 Fe(IV)-氧代物質 E。 (vi) 在最後在催化迴圈的步驟中,中間體 E 從底物中提取一個氫原子以產生 Fe(III)-OH 中間體 F,(vii) 隨後羥基自由基反彈形成羥基化產物 G。 (viii) 產物和琥珀酸酯然後與酶解離,空置的 Fe(II) 配體位置再次被三個水分子佔據,以重新生成酶靜止狀態 A。在大多數情況下,羥基化產物不穩定併發生自發斷裂,生成甲醛和去甲基化產物。
圖1c. AlkB 去甲基化酶的共識機制。除了分子氧配合物 C、D 和 Fe(III)-OH 中間體 F 外,所有中間體都有證據(圖片來源:J. Med. Chem.)。
5. AlkB 脫甲基酶的小分子抑制劑
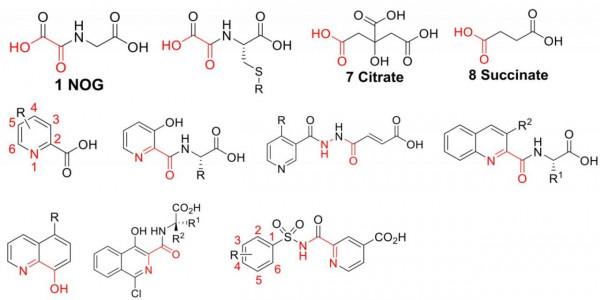
在過去的幾十年裡, AlkB 去甲基化酶抑制劑開發的巨大進步。一系列去甲基化酶測定方法的發展和大量高解析度晶體結構的可用性極大地促進了抑制工作,這提供了豐富的結構資訊,以實現基於結構和計算引導的抑制劑設計。絕大多數已鑑定的抑制劑可根據其結合方式分為三大類,即 (1) 在 2OG 結合位點與鐵複合的抑制劑,(2) 僅與底物結合位點結合的抑制劑, (3) 結合方式不確定的抑制劑。
5.1.在2OG結合位點與鐵複合的抑制劑
大多數早期的 AlkB 脫甲基酶抑制劑是2OG競爭性抑制劑。此類抑制劑的一個特徵是它們帶有金屬結合彈頭(例如草醯、吡啶基羧酸酯和醯基肼基團),這使它們能夠螯合到 2OG 結合位點的活性位點金屬,通常以類似於雙齒的方式到 2OG。這些抑制劑主要是透過高通量篩選、動態組合質譜 (DCMS) 方法和基於結構的設計發現的。
5.2.專門與底物結合位點結合的抑制劑
最近對AlkB脫甲基酶的抑制工作開始揭示一類具有新結合模式的新型抑制劑,它與活性位點金屬螯合不同。該抑制劑類化合物僅與底物結合位點結合,並且與含有特徵性金屬螯合部分的 2OG 競爭性抑制劑不同,它們在化學上是多樣的,並且不具有任何易於識別其結合模式的特定結構特徵。這些化合物主要是透過高通量計算機和/或生化篩選發現的。
5.3.結合模式不確定的抑制劑
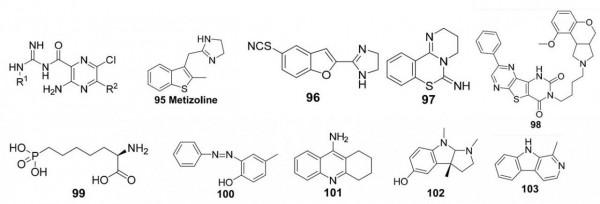
這類抑制劑中的大多數化合物是具有廣泛生物靶點和藥理活性的天然產物。儘管如此,從抑制劑設計的角度來看,它們是非常有趣的化合物,因為它們多樣化的結構為新型抑制劑骨架提供了新的靈感。
參考文獻:
https://doi-org.ezproxy.lb.polyu.edu.hk/10.1021/acs.jmedchem.1c01694