作者:Catherine Higginson, MS; Veronika Schweighart, MS; Robert Radloff, MBA
2021年年中,一項調查啟動,用來評估歐洲醫療器械製造商和製藥公司在哪些方面遇到了臨床試驗中最大的挑戰,以及預計未來幾年這一領域的趨勢。其中調查發現最大的挑戰包括人員的缺乏,時間的投入,研究方案的複雜性,合適物件的確定以及資料的分析和出版。
雖然大多數參與者尚未進行分散式試驗,但超過三分之二的人表示他們計劃在未來幾年內使用它們。
臨床試驗對於醫學進步至關重要。然而,鑑於疫情的大流行,大多數臨床試驗地點(與COVID-19相關的地點除外)都經歷了時間延遲,有時甚至完全停止了運營,這影響了臨床研究成果。
在這項新的調查中,Climedo Health和Cureadtis希望找出歐盟(EU)公司面臨的其他挑戰,特別是在不同的研究階段以及市場批准之前和之後。另一個目標是評估技術趨勢的狀況,例如分散式臨床試驗(DCTs),這在面對COVID-19時受歡迎程度增加。
調查最終結論
根據調查結果顯示,無論是上市前還是上市後研究,臨床試驗顯然在三個研究階段(規劃階段、實施階段、收尾階段)都面臨著醫療技術公司和製藥公司的許多挑戰。但無論階段或研究型別如何,我們的資料一致表明,擁抱數字技術被視為克服這些困難的關鍵解決方案之一。
我們在分析過程中注意到的一個有趣的觀點是,與醫療技術公司相比,製藥公司的處境似乎略微更好:在比較他們的回答時,我們不僅發現製藥公司認為所有三個研究階段總體上都不那麼具有挑戰性,而且製藥公司比醫療技術公司在幾乎所有的數字化領域都看到了更多的潛力。
在日益數字化的世界中,一切都表明,如果沒有分散的研究解決方案,我們的醫療保健行業是不可持續的。COVID-19以及由此加速的許多行業的數字化轉型只會加強這一趨勢。
繼續依賴傳統臨床試驗的公司面臨落後於使用DCT的競爭公司的風險,後者可能會更好地將其醫療創新更快地推向市場,並繼續進行高質量的研究,並可能在獲得市場批准後發現新的適應症。
雖然DCT需要公司進行大量的規劃,投資和變更流程,但長期效益將遠遠超過初始成本,並使公司能夠加速臨床試驗並涉及更大,更多樣化的患者群體——無論是在疫情大流行期間還是之後。
接下來將從調查的參與者和方法、三個研究階段的具體調查結果、未來展望三個方面來詳細介紹:
- 調查參與者和調查方法:
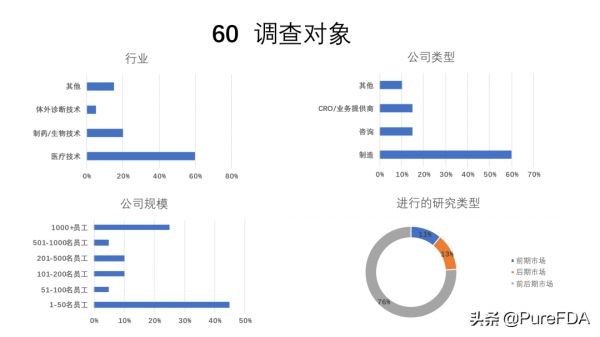
2021年夏天,共有60名來自歐洲的參與者參加了調查。65%的參與者為醫療器械製造商工作,22%來自制藥或生物技術公司。其餘的則為體外診斷或其他公司工作。為了保持代表性,非製造商被要求代表他們的客戶回答問題。就公司規模而言,69%的參與者為員工人數不超過500人的組織工作,31%的參與者為員工人數超過500人的公司工作。
我們還對這些公司進行的研究型別感興趣,即上市前,上市後或兩者兼有。11%的人表示他們只進行了上市前研究,13%的人表示只進行了上市後研究,其餘76%的人表示他們進行了這兩項研究。
Climedo Health的線上調查工具用於收集和評估調查回覆。
(來源:歐洲臨床研究中的挑戰和機遇 2021)
普瑞君說:本文將在PureFDA公眾號進行持續連載,請持續關注我們,後續將為您帶來《歐洲醫療器械臨床試驗的挑戰與機遇II 》。
END