歡迎關注凱萊英藥聞
罕見病不僅由於其患病率低,臨床診斷難度大,同時也因其複雜的患病機制和極低的患病人群基數,常常面臨“無藥可醫”的困境。近年來,隨著基因治療、核酸藥物等技術的逐漸成熟,多個罕見病適應症無藥可用的局面被打破,眾多罕見病患者及其家庭開啟了新的篇章。本期文章,我們將重點介紹Rett綜合徵和該適應症潛在的肽類IGF1調節劑新藥trofinetide。
No.1 Rett綜合徵
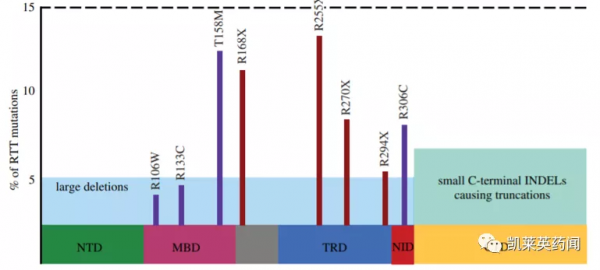
Rett 綜合徵 (RTT) 是一種由X染色體連鎖基因甲基-CpG結合蛋白2 ( MECP2 )突變引起的神經系統疾病,後者是一種普遍表達的轉錄調節因子。儘管自發現以來取得了顯著的科學進展,但MECP2突變導致RTT的機制在很大程度上是未知的。MECP2突變的範圍很廣,包括點突變、插入、重複、缺失等,但有8個錯義和無義突變(R106 W、R133C、T158M、R168X、R255X、R270X、R294X 和 R306C)佔RTT中所有突變的大約70%(見下圖)。
RTT主要影響女孩,女性發病率約為1: 10000–15000。在生命的前6-18個月經歷一段正常的神經和身體發育期後,RTT的第一個特徵開始在兒童早期顯現,並在幾個階段逐漸出現,包括停滯期(6-18個月)、快速退化期(1-4歲)、假靜止期(2歲及之後)和晚期運動退化(10歲及之後)。
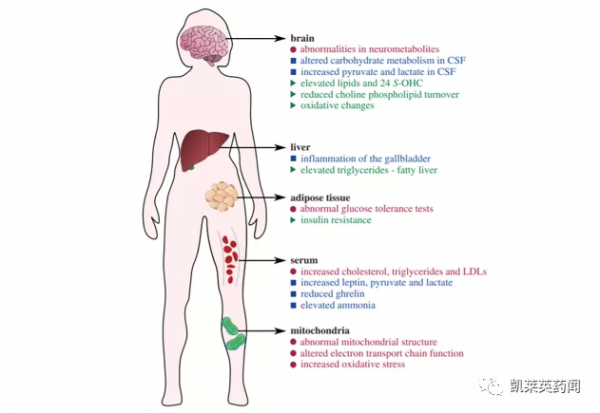
RTT的臨床特徵主要包括語言和運動技能喪失、重複的手部運動、呼吸不規則和癲癇發作。還可能患有胃腸道問題、發育不全、早發性骨質疏鬆症等。此外,代謝併發症在RTT中也很常見。許多患者出現血脂異常,血漿瘦素(Leptin)和脂聯素升高,氨升高和膽囊炎症等。
備註:藍色-RTT患者;綠色-MECP2突變小鼠模型;粉色-常見代謝紊亂。
目前,針對RTT尚無特異性治療藥物獲批上市,但有多款產品已進入臨床研究階段:
No.2 IGF1與RTT
胰島素樣生長因子 1 (IGF1) 是一種多肽激素,含有 70 個氨基酸。IGF1是胰島素樣肽(ILP) 的相關胰島素樣激素超家族的成員,該家族成員包括胰島素、IGF-1和IGF-2,它們雖然擁有相似的三級結構和一級氨基酸序列,但透過與不同的受體結合發揮不同的生理作用。IGF-1 主要由肝細胞響應生長激素釋放,作為一種神經營養多肽,IGF1在中樞神經系統 (CNS) 的生長、發育和成熟中起關鍵作用。
在中樞神經系統中,IGF1透過與其受體 (IGF1R) 結合來發揮作用。IGF1R的啟用導致募集各種分子以啟用PI3K/mTOR和MAPK/ERK等訊號通路。其中,PI3K/mTOR通路在調節細胞週期/存活、基因表達和細胞骨架重塑中發揮重要作用;MAPK/ERK通路在基因表達、細胞存活和分化中發揮重要作用。ERK還可靶向核轉錄因子,後者對於誘導促進細胞存活、分裂和運動的基因表達十分重要。
此外,IGF1透過啟用PI3K/Akt通路抑制細胞凋亡,從而促進細胞存活。
IGF1在中樞神經系統(CNS)的發育、成熟等過程中發揮了重要作用,而相關重要性也體現在RTT中。研究發現,引起RTT的MECP2的一個明確的功能特徵靶點是腦源性神經營養因子(BDNF),後者是中樞神經系統生長的重要調節因子,在中樞神經系統中與IGF1具有協同作用。同時,BDNF在RTT小鼠模型和RTT患者中下調。
動物模型研究發現大腦和外周血液之間存在明顯的BDNF交換,而IGF1在穿過血腦屏障時作用於與BDNF相同的訊號通路,如PI3K-Akt、MAP-ERK等。還具有增加核MECP2轉錄物和蛋白質的功能。
No.3 Trofinetide
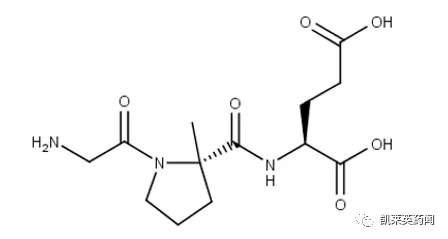
Trofinetide是由Neuren Pharmaceuticals 和ACADIAPharmaceuticals(北美地區開發及商業化權利)共同開發的一款肽類IGF1調節劑,是一種IGF1的氨基末端三肽的類似物。
Trofinetide透過三種途徑改善RTT症狀:
- 改善突觸功能和恢復突觸結構;
- 抑制炎症性小神經膠質細胞和星形膠質細胞的過度啟用;
- 增加大腦中IGF-1的數量。
Trofinetide已獲得FDA的Fast Track認證,和針對Rett綜合徵的Orphan Drug認證。此外,trofinetide還被FDA授予罕見兒科疾病 (Rare Pediatric Disease,RPD) 資格。
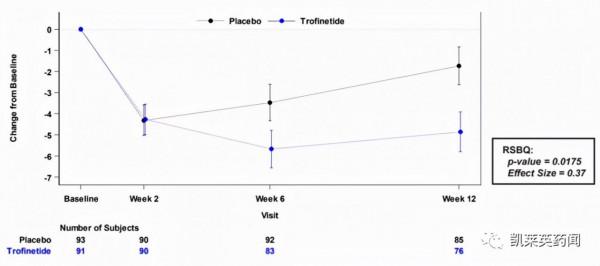
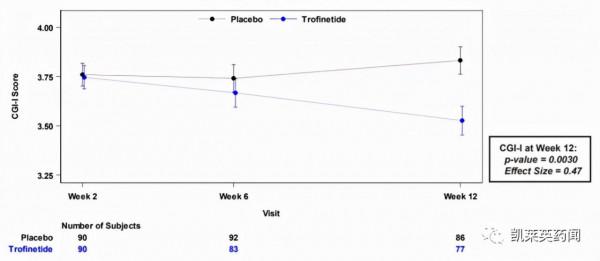
目前,trofinetide已完成了針對RTT的III期臨床試驗。該項臨床是一項為期12周、隨機、雙盲、安慰劑對照的III期試驗(NCT04181723;LAVENDER),試驗共招募了187名 5-20 歲患有RTT的女孩和年輕女性,旨在評估trofinetide治療RTT的有效性和安全性。共同主要療效終點包括Rett 綜合徵行為問卷 (RSBQ)評分和臨床總體印象改善(CGI-I)評價,次要療效終點為嬰幼兒溝通和象徵性行為量表(CSBS-DP-IT)評分。
2021年初,III期臨床的陽性頂線結果釋出。試驗結果顯示,在RSBQ指標上,第12周時,trofinetide組顯著優於安慰劑組(-5.1 vs. -1.7;p=0.0175;effect size=0.37)。
在CGI-I指標上,第12周時,trofinetide組相較於安慰劑組同樣取得了顯著性改善(3.5 vs. 3.8;p=0.0030;effect size=0.47)。
在次要終點CSBS-DP-IT評分上,trofinetide同樣為RTT患者帶來了顯著性改善(p = 0.0064)。
在安全性方面,與治療相關不良事件(TEAE)所導致的研究停藥率,trofinetide組為17.2%,安慰劑組為2.1%。
最常見的不良事件有腹瀉、嘔吐、癲癇發作、發熱、食慾減退、易怒等。
Acadia計劃在2022年第一季度與FDA舉行NDA前會議,並計劃在2022年年中左右提交NDA申請。