喜歡就關注我們吧,訂閱更多最新訊息

第一作者:Chuan Tan
通訊作者:陳宇輝,沈炎賓,
通訊單位:南京工業大學,中國科學院蘇州奈米技術與奈米仿生研究所,
論文DOI:https://doi.org/10.1021/jacs.1c09916
全文速覽
在追求出色的Li-O2電池時,陰極中的真實反應位點決定了其電池效能和催化劑設計。當第一層絕緣Li2O2固體在放電過程中沉積在電極基板上時,隨後的O2還原為Li2O2可能發生在電極|Li2O2介面或Li2O2|電解質介面。眾所周知,機理決定催化劑設計的策略;然而,該機理目前仍然是神秘的。在這裡,作者使用旋轉環盤電極沉積了緻密的Li2O2薄膜,並用16O/18O同位素標記了Li2O2產物。透過使用Li216O2和Li218O2的特徵訊號識別Li2O2薄膜中Li216O2和Li218O2的分佈。結果表明O2在兩個介面都被還原為Li2O2。當電極在16O2和18O2下放電時,在電極表面識別出Li218O2|Li216O2|Li218O2的夾層結構。電極|Li2O2介面是主要反應位點,佔整個反應的75%。這種新機理為Li-O2電池的催化劑設計提出了新的途徑和新的策略。
背景介紹
鋰空氣電池具有3500Wh kg-1的高比能量(基於形成Li2O2的陰極反應);然而,其效能受到正極反應的限制,即容量低、過電位大、迴圈性差。在陰極反應(即Li2O2的可逆形成和分解)的催化劑設計方面,研究人員已經報道了大量工作。大量的催化劑設計,包括均相催化劑(如可溶性氧化還原介質)和非均相催化劑(如金屬合金、金屬氧化物、MOFs等)已被廣泛探索用於降低過電位,增加容量,提高可迴圈性。然而,到目前為止,真正的反應位點,即O2分子被還原以產生Li2O2的位置,尚未明確。催化劑在放電和充電過程中的工作方式仍存在爭議,特別是當催化劑表面覆蓋有一層薄薄的絕緣Li2O2時。因此,它給鋰空氣電池催化劑設計的研究人員帶來了困惑。例如,如果O2在Li2O2產物的表面而不是在催化劑表面被還原,則均相催化劑將比非均相催化劑更有效。或者,是否可以將金屬離子引入Li2O2晶格以實現自催化Li2O2。
通常,放電過程包括兩條競爭路線,即溶液路線和表面路線。在溶液路線中,O2首先被還原為溶解的超氧化物,O2–(sol)或LiO2(sol),在遠離電極表面的電解質溶液中進一步被還原或歧化,最終在溶液中生成Li2O2。Li2O2顆粒在溶液路徑中遵循從核到殼生長。在表面路徑中,O2在電極表面被還原為超氧化物,並進一步還原為Li2O2膜。這兩條路線作為競爭過程同時發生。它們的競爭取決於許多因素,例如放電電位、電解質的溶劑化能力、超氧化物中間體在電極表面的吸附能等。
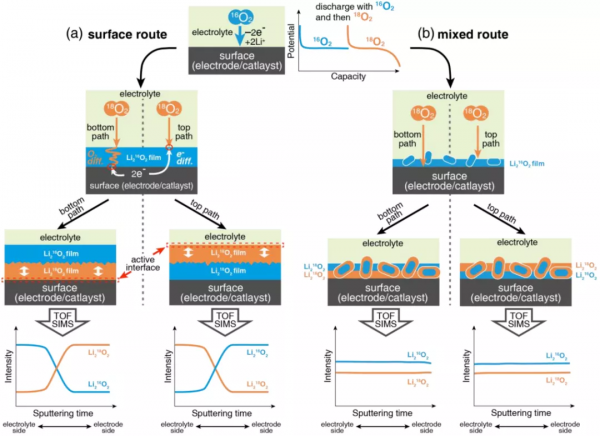
表面路線的詳細機理尚未完全闡明。關鍵問題是當表面被具有低離子和電子電導率(~10-19 S cm-1)的單層Li2O2覆蓋時,反應如何繼續進行。以下反應可能發生在電極| Li2O2介面(表示為底部路徑)或Li2O2|電解質介面(表示為頂部路徑),如圖1所示。真正的反應位點是未知的,而隨後的反應機理也在爭論中。在底部路徑中,由於O2的溶解度和擴散性受限,O2向底部的傳質被厚的Li2O2膜阻礙,因此,它很可能是速率決定步驟。在O2被還原為Li2O2之前,O2必須透過Li2O2薄膜擴散,以跟隨薄膜的缺陷到達電極和催化劑的表面,如圖1a所示。在頂部路徑中,電子傳輸成為速率決定步驟,O2在遠離催化劑表面的Li2O2|電解質介面處被還原。儘管塊狀Li2O2的離子和電子電導率較低,但一些缺陷可以提高電導率以實現頂部路徑。更重要的是,在頂部路徑中,O2的還原發生在Li2O2的表面,而不是在催化劑上;因此催化劑的作用減弱了。如果頂部路徑占主導地位,則由於缺乏與O2的直接接觸,非均相催化劑的影響最小化,因此必須探索可溶性催化劑和自催化Li2O2等替代品。
圖文解析
圖1. 電極|Li2O2和Li2O2|電解質介面處反應位點的反應機理示意圖,以及由(a)純表面路線和(b)混合路線(表面路線+溶液路線)引起的不同TOF-SIMS曲線。
圖2. RRDE 在0.1 M LiClO4–DME中的放電曲線,轉速為4000 rpm。(a) 0.1 M LiClO4–DME中O2還原的CV,顯示了盤電流(jdisk)、環電流(jring)以及由溶液路徑(jsolution)和表面路徑(jsurface)貢獻的電流。掃描速率為10 mV s–1。(b)在2.4 V vs Li+/Li的恆電位放電期間,表面路徑貢獻的電流和容量。(c)放電結束時RRDE Au 圓盤電極的拉曼光譜。
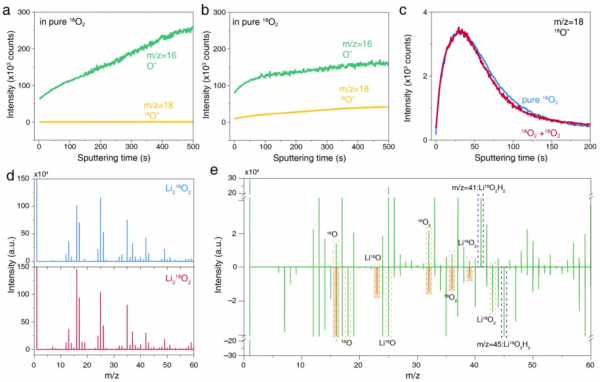
圖3.Li216O2和Li218O2的TOF-SIMS光譜和深度剖面分析。(a, b) 在(a)純16O2和(b)純18O2中放電的電極中,m/z = 16 (16O–)和m/z = 18 (18O–)的深度分佈。(c)在純16O2和16O2+18O2中放電的電極中,m/z = 18 (18O–)的深度分佈比較。(d) Li216O2和Li218O2的全光譜。(e)減去Li218O2曲線的Li216O2的差分TOF-SIMS曲線。
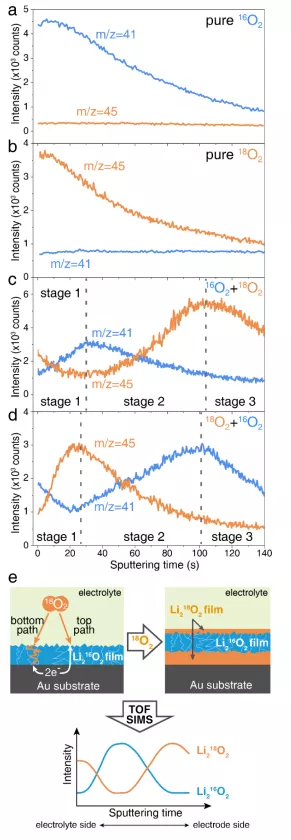
圖4. RRDE 電極在(a)16O2、(b)18O2、(c)16O2+18O2和(d)18O2+16O2下,0.1 M LiClO4–DME中放電的TOF-SIMS深度分佈。(e)在16O2+18O2下放電的電極夾層結構示意圖。
總結與展望
基於上述結果,作者使用RRDE製備了具有表面路徑的緻密Li2O2薄膜。電極先在16O2(18O2)中放電,然後在18O2(16O2)中放電,分別沉積Li216O2和Li218O2。作者對這些樣品進行了TOF-SIMS測試分析,發現m/z = 16 和m/z = 18 訊號不能分別代表Li216O2和Li218O2,尤其是在如此薄的Li2O2薄膜中。作者應用m/z = 41 和m/z = 45 處的新特徵訊號來識別最終放電產物中Li216O2和Li218O2的分佈。TOF-SIMS深度剖面顯示,在電極| Li2O2介面(底部路徑)和Li2O2|電解質介面(頂部路徑)處,O2都被還原了。前者是主要過程,產生了75%的Li2O2產物。它需要O2透過Li2O2薄膜擴散到達電極|Li2O2介面。因此,Li2O2薄膜的性質及其生長機理是決定電池效能的關鍵因素。不幸的是,這個過程還沒有被很好的理解,值得進行更多的研究。另一方面,Li2O2|電解質介面的反應不容忽視。透過Li2O2層的電子傳輸,在Li2O2產物的上表面仍有一小部分O2被還原。這部分反應超出了普通催化劑所能達到的範圍,需要在未來的工作中進行更多的研究。