《柳葉刀-數字醫療》(The Lancet Digital Health)近日發表由中山大學附屬第六醫院放療科萬香波主任醫師團隊以及中國科學院自動化研究所田捷教授團隊合作牽頭完成的一項基於人工智慧預測區域性晚期直腸癌新輔助放化療療效的最新研究。本研究創新性提出整合影像組學和病理組學“兩層面”模態特徵的建模策略,成功研發出一套可準確預測直腸癌新輔助療效的人工智慧系統(RAPIDS),並在多中心外部資料集和前瞻性臨床試驗中完成出色驗證,有望成為直腸癌新輔助放化療療效個體化預測的新手段。柳葉刀特別邀請作者團隊為讀者帶來文章解讀。
作者介紹
醫學博士、主任醫師、博士研究生導師,中山大學附屬第六醫院放療科學術帶頭人、科室副主任。擅長消化道腫瘤放射治療、放射損傷與防護。任中國抗癌協會大腸癌專委會放療學組委員、中國醫師協會結直腸腫瘤專委會放療學組委員
醫學博士(腫瘤學),就讀於中山大學附屬第六醫院放療科。研究方向為消化道腫瘤放射治療、放射損傷與防護,人工智慧真實世界研究
文章解讀
研究背景
新輔助放化療聯合全直腸繫膜切除術(total mesorectal excision,TME)和輔助化療是區域性晚期直腸癌的標準治療方案,[1,2]其中15%-27%的病人在術後證實獲得“病理完全緩解(pathological complete response,pCR)。[3]研究表明,pCR患者的遠期生存率顯著高於非pCR患者,且因組織內無腫瘤細胞殘留,可考慮透過嚴密隨訪監測的“等待觀察”策略替代外科手術,以避免手術帶來的風險和併發症,最終獲得既“活得久”(生存期達正常壽限)又“活得好”(避免放療及術後相關不良反應及併發症)的完美效果。[4]因而,若能在治療前篩選出對放化療特別敏感的患者,透過給予標準或強化的新輔助治療方案,以提升患者pCR率,最終達到延長生存期和提升生存質量的雙重獲益。因此,建立高效準確的直腸癌新輔助療效預測方法,對直腸癌的個體化治療具有重要意義。
近年來,人工智慧在疾病診斷、療效評估和預後預測等方面表現出獨特的優勢。[5–8]然而,已報道的人工智慧模型預測直腸癌新輔助放化療療效的研究,大多基於小樣本、單中心、回顧性資料。重要的是,既往的研究都是基於影像組學單一模態影象,因而無法全面捕獲疾病的特徵,存在模型過擬合及無充分的外部驗證等問題。[9–11]針對這些問題,此研究基於多中心、大規模直腸癌人群樣本,研發了全新的、整合影像組學及病理組學“兩層面”特徵的直腸癌新輔助放化療療效預測模型——RAPIDS(RAdioPathomics Integrated prediction System),並進行多中心外部驗證和前瞻性臨床驗證,為臨床上直腸癌個體化治療提供新穎手段。
研究方法
本研究先回顧性納入了933例接受了新輔助同步放化療和TME手術的區域性晚期直腸癌患者,其中來自中山大學附屬第六醫院的303例作為模型訓練集,來自中山大學腫瘤防治中心和雲南省腫瘤醫院的480例和150例分別作為兩個獨立外部驗證集。同時,採集所有患者治療前盆腔MRI影像和內鏡下活檢病理HE切片掃描影象,由經驗豐富的影像診斷科醫師和病理醫生勾畫腫瘤圖層作為機器學習的感興趣區域。利用深度學習方法,研究團隊構建了整合影像組學及病理組學“兩層面”特徵的多模態預測模型——RAPIDS,並在兩個獨立外部驗證集中測試了RAPIDS預測直腸癌新輔助治療療效的準確性,同時比較RAPIDS與傳統的單模態預測模型的表現差異。更進一步,研究團隊開展了一項前瞻性、觀察性臨床試驗(ClinicalTrial.gov NCT04271657),在患者接受新輔助治療前由RAPIDS預測其是否可以達到pCR,並與新輔助放化療治療後手術病理結果進行比較,以驗證RAPIDS在真實世界中的預測效能(原文圖1)。
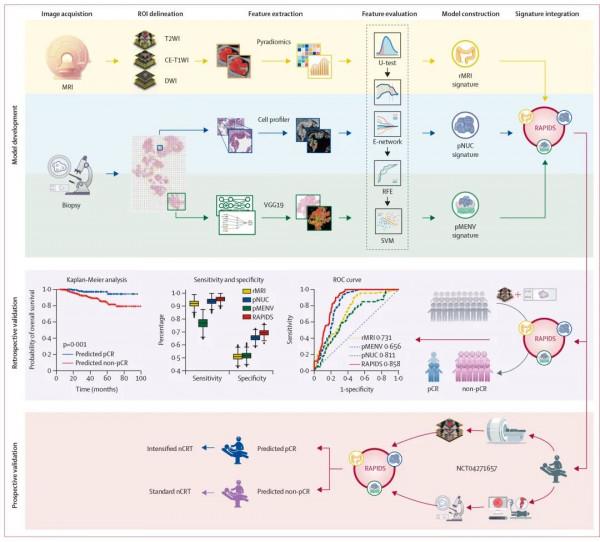
Figure 1: Workflow of the study
研究結果
(1)RAPIDS的研發和外部驗證
研究團隊從直腸癌患者治療前的MRI影像(包含三個橫斷面序列:T2加權,T1增強,彌散加權)提取出2106個影像組學特徵(rMRI),同時基於深度學習從活檢病理全切片影象中分別提取770個細胞核特徵(pNUC)和220個病理微環境特徵(pMENV)。經過一系列的特徵篩選和最佳化調整,最終篩選出與直腸癌放化療敏感性最相關的9個rMRI特徵、12個pNUC特徵以及18個pMENV特徵,構建了SVM多模態預測模型——RAPIDS。出於對比模型預測效能的考量,研究團隊將以上特徵集單獨或兩兩組合,分別構建了3個單模態模型和3個雙模態模型。
經過外部驗證,RAPIDS預測直腸癌新輔助放化療療效的平均受試者操作特徵曲線下面積(AUC)均達到85%以上,其中外部驗證集1的AUC為0.860(95%CI 0.828-0.892),外部驗證集2的AUC為0.872(95%CI 0.810-0.934)(原文表2,圖2)。
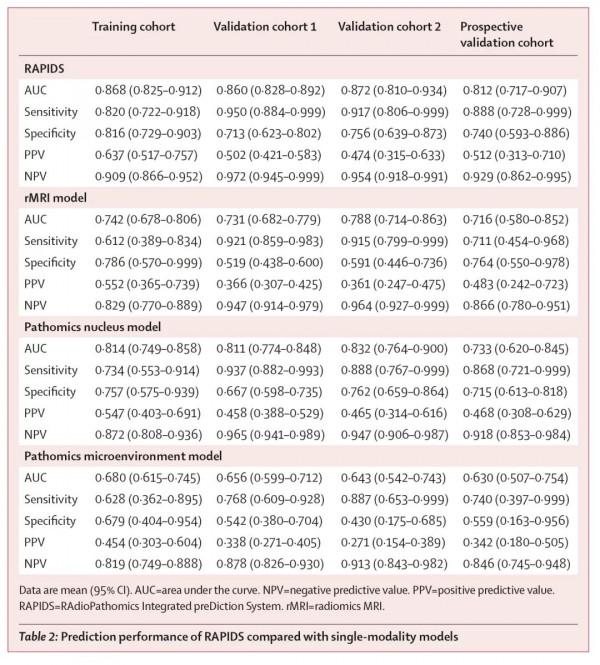

Figure 2: Prediction performance of RAPIDS versus single-modality prediction models in the retrospective training and validation cohorts
(2)RAPIDS在臨床真實世界驗證中可準確預測直腸癌新輔助放化療療效
在前瞻性臨床實驗中,研究團隊模擬了RAPIDS在臨床真實世界的應用場景。直腸癌初治患者入院後常規進行盆腔MRI影像檢查和腸內鏡下活檢病理檢測,臨床醫生利用這些影象完成腫瘤臨床診斷的同時,交由RAPIDS進行影象分析並預測出該患者的新輔助治療療效。在不干預患者接受標準新輔助治療的情況下,RAPIDS的預測效能穩定,AUC為0.812(95%CI 0.717-0.907)(原文圖3)。儘管這是一項觀察性臨床試驗,RAPIDS在臨床真實環境下的預測能力得到證實,有望作為直腸癌個體化治療的輔助依據。
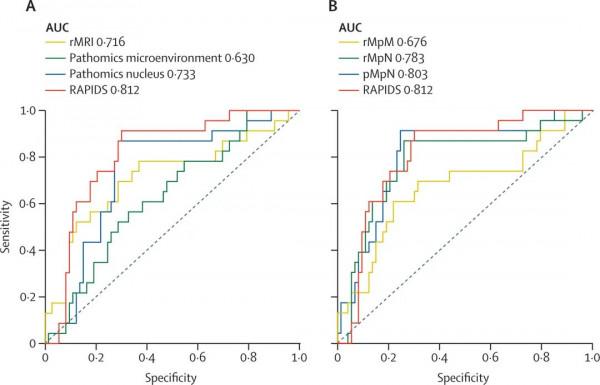
Figure 3: Prediction performance of RAPIDS versus single-modality and dual-modality prediction models in the prospective observational study
(3)多模態特徵融合顯著提升模型預測效能
既往的預測模型研究多基於單一的醫學影象如單純影像或病理影象,但不同模態的影象在呈現疾病資料特徵上具有不同的權重。研究團隊發現,整合影像組學及病理組學“兩層面”的多模態影象特徵可更加全面地捕獲腫瘤特徵,從而提升模型預測效能。例如,在回顧性外部驗證和前瞻性臨床驗證中,RAPIDS的預測能力(AUC 0.812-0.872)均優於傳統的單模態預測模型(rMRI:0.716-0.788;pNUC:0.733-0.832;pMENV:0.630-0.656),以及雙模態預測模型(rMpM:0.676-0.756;rMpN:0.783-0.854;pMpN:0.803-0.846)(原文表2,圖2-3)。赤池資訊準則(Akaike Information Criterion,AIC)檢驗RAPIDS模型在增加模態特徵以提升模型預測效能的同時沒有出現過擬合現象。
結論
這是一項基於國內較大宗病例、涵蓋多中心外部驗證和前瞻性臨床驗證的直腸癌新輔助放化療療效預測的人工智慧研究。該研究創新性地提出整合“兩層面”模態(病理“微觀”腫瘤細胞層面及影像“宏觀”腫瘤組織層面)特徵的建模策略,以實現腫瘤異質性特徵的相互補充,顯著提升模型效能。研究團隊充分利用影像和病理這兩種臨床上普遍且必須的診斷影象,初步建立起一套直腸癌新輔助放化療療效預測體系,並以此為參考制定新輔助治療策略,這對於利用人工智慧系統輔助直腸癌個體化診療具有開創性意義。
此外,該研究採用了直腸癌新輔助放化療前MRI影像預測pCR的建模策略,有效的規避了新輔助放化療引起的放射性直腸損傷的干擾訊號,提高了人工勾畫腫瘤區域的準確性,優化了模型效能。但基於本研究團隊既往利用直腸癌新輔助治療後MRI影像預測pCR的研究經驗,[12]新輔助治療後MRI影像雖可提供更加直接的腫瘤反應後特徵,是預測pCR的最直觀證據,但由於放射性直腸肛管損傷因素的干擾,導致pCR診斷率低下。如何利用人工智慧鑑別診斷放射性腸組織損傷與腫瘤殘留,以更精準的鑑別pCR和診斷放射性直腸肛管損傷?研究團隊的結果提示,本研究對於直腸非放射性損傷組織(正常直腸及直腸腫瘤)識別的研究經驗可作為“第一步”的積累,為後續識別直腸放射性損傷組織奠定基礎,有望透過人工智慧輔助,最終解決新輔助放化療後MRI影像診斷pCR準確率低這一臨床難題。END
參考文獻
[1] Dekker E, Tanis PJ, Vleugels JLA, Kasi PM, Wallace MB. Colorectal cancer. Lancet 2019; 394: 1467–80.
[2] Glynne-Jones R, Wyrwicz L, Tiret E, et al. Rectal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2017; 28: iv22–40.
[3] Maas M, Nelemans PJ, Valentini V, et al. Long-term outcome in patients with a pathological complete response after chemoradiation for rectal cancer: A pooled analysis of individual patient data. Lancet Oncol 2010; 11: 835–44.
[4] Smith JJ, Strombom P, Chow OS, et al. Assessment of a Watch-and-Wait Strategy for Rectal Cancer in Patients with a Complete Response after Neoadjuvant Therapy. JAMA Oncol 2019; 5: 1–8.
[5] Schwalbe N, Wahl B. Artificial intelligence and the future of global health. Lancet. 2020; 395: 1579–86.
[6] Kather JN, Krisam J, Charoentong P, et al. Predicting survival from colorectal cancer histology slides using deep learning: A retrospective multicenter study. PLoS Med 2019; 16: 1–22.
[7] Niazi MKK, Parwani A V., Gurcan MN. Digital pathology and artificial intelligence. Lancet Oncol. 2019; 20: e253–61.
[8] Liu Z, Wang S, Dong D, et al. The applications of radiomics in precision diagnosis and treatment of oncology: Opportunities and challenges. Theranostics. 2019; 9: 1303–22.
[9] Bulens P, Couwenberg A, Intven M, et al. Predicting the tumor response to chemoradiotherapy for rectal cancer: Model development and external validation using MRI radiomics. Radiother Oncol 2020; 142: 246–52.
[10] Nie K, Shi L, Chen Q, et al. Rectal cancer: Assessment of neoadjuvant chemoradiation outcome based on radiomics of multiparametric MRI. Clin Cancer Res 2016; 22: 5256–64.
[11] Horvat N, Veeraraghavan H, Khan M, et al. MR imaging of rectal cancer: Radiomics analysis to assess treatment response after neoadjuvant therapy. Radiology 2018; 287: 833–43.
[12] Shao L, Liu Z, Feng L, et al. Multiparametric MRI and Whole Slide Image-Based Pretreatment Prediction of Pathological Response to Neoadjuvant Chemoradiotherapy in Rectal Cancer: A Multicenter Radiopathomic Study. Ann Surg Oncol 2020; 27: 4296–306.



















