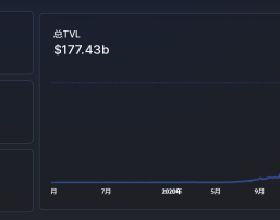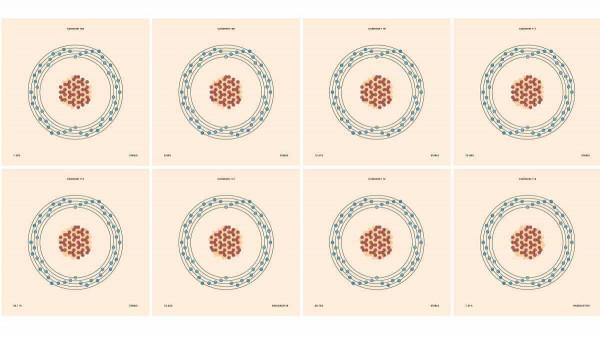
鎘的一系列同位素。圖片來源:Patricia F Carvalho / Getty Images
如果您是科學新聞的熱心讀者,您可能已經在幾篇主題截然不同的文章中看到“同位素”或“同位素分析”這些詞。這些主題包括地質學、天文學、古生物學、核科學、歷史、生態學和化學。
那麼同位素到底是什麼,為什麼它們在這麼多不同的領域都有應用呢?
什麼是同位素?
答案在於化學和原子結構。
並非所有原子都是相同的。雖然相同元素的所有原子具有相同數量的質子(根據元素週期表,氫有一個質子,氦有兩個,鋰有三個,依此類推),但它們並不總是具有相同數量的中子。
宇宙中大約 99.98% 的氫原子沒有中子,但其餘 0.02% 的氫原子大多有一箇中子。因為中子的質量與質子相似,這使得這 0.02% 的氫原子質量稍大一些,或者說,在地球上,稍重一些。
這兩種不同型別的氫原子被稱為彼此的同位素。

兩個鋰原子核。雖然兩者都有三個質子,但一種同位素有三個中子,而另一種有四個。
大多數其他元素也有幾種同位素。例如,大約 92% 的矽原子有 14 箇中子,5% 有 15 箇中子,3% 有 16 個。(還有一些微量的其他矽同位素)。
我們如何使用它們呢?
因為原子如此之多,即使是各種同位素濃度的微小差異,也可以用來獲取新的資訊。
例如,不同岩石之間鍶同位素的濃度是不同的,這意味著不同的區域有不同的鍶“特徵”。去年,一組澳大利亞科學家使用這些鍶特徵來定位阿德萊德地區周圍考拉牙齒的起源。
這也不是地球特有的情況。例如,一些美國科學家已經使用同位素來確定隕石不同部分的起源。這種同位素特徵的分析結果可以非常精確。
當我們開始研究同位素的物理特性時,我們可以瞭解到更多。因為所有這些原子的質量都略有不同,所以在某些情況下它們的表現也會略有不同。例如,在地球上,含有較輕氧同位素的水 (H2O) 蒸發得更好,而含有較重氧同位素的 H2O 往往沉澱得更快。
這意味著,根據全球各地的蒸發量和降雨量,雨中氧同位素的濃度會略有不同。我們可以利用這些資訊得出關於某個地區的氣候和氣候歷史的結論,所有這些都是透過觀察氧同位素來實現的。
生物也區分同位素。例如,一些植物在吸收二氧化碳進行光合作用時更喜歡較輕的碳原子。研究人員可以透過檢查植物的碳同位素來了解植物的呼吸量。
最後,一些不穩定的同位素,放射性同位素,會分解。有時,它們在此過程中會釋放大量能量:這就是核能的來源。
其他同位素分解得極其緩慢,需要數千到數十億年才能耗盡。如果我們能算出這些放射性同位素分解需要多長時間,我們就可以利用同位素的濃度來算出事物的年齡。
這是輻射測年的基石,用於確定從岩石到人類遺骸的一切事物的年齡。
我們如何識別不同的同位素?
原子可以在被稱為質譜儀的裝置上進行“稱重”。這臺機器透過略微彎曲其路徑的磁場將原子拋向探測器。質量較大的原子不太傾向於彎曲其路徑,這意味著它們會在不同的點撞擊探測器。
在撰寫有關同位素的文章時,研究人員傾向於使用數字來區分它們。“較輕的氧同位素”和“較重的氧同位素”並不是真正足夠精確的術語,特別是在使用具有兩種以上天然存在的同位素的元素時。(而且重量和質量並不完全相同。)
同位素通常用一個將它們的質子和中子加在一起的數字來表示,所以沒有中子的氫被稱為1H,來表示它有的單個質子,而較重的氫是2H ,來表示還有一箇中子。
同位素16O 有 8 個質子和 8 箇中子,而稀有的17O 和18O 分別有 9 個和 10 箇中子。有時,也寫為氧-16 或氧-18。