1月13日,武漢禾元生物科技股份有限公司收到美國食品藥品監督管理局同意禾元生物自主研發的注射用α1-抗胰蛋白酶(AAT)(HY1003)進行臨床試驗的通知函。這是全球首個重組α-1抗胰蛋白酶經美國食品藥品監督管理局批准進入臨床試驗,也是禾元生物第二個獲得美國食品藥品監督管理局批准進入臨床的重組血液製品。
該專案於2020年獲得美國FDA 孤兒藥資格認定(DRU-2019-7242),可用於AAT缺失或其他原因引起的肺氣腫治療。美國食品藥品監督管理局認為由該技術平臺生產的重組α-1抗胰蛋白酶相較於人血來源同品種藥物可避免傳染性病原體汙染,在安全性上具有明顯優勢。
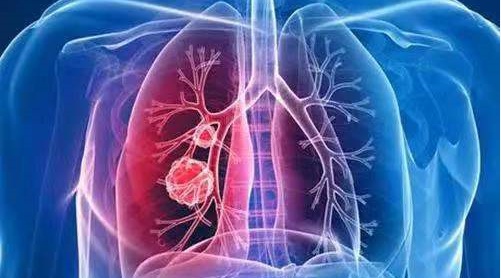
α-1抗胰蛋白酶(AAT)由人14號染色體上SERPINA1基因編碼,該基因突變引起的α-1抗胰蛋白酶在血漿水平低下或變性,它會損害肺中的微小氣囊(肺泡),導致肺氣腫。當肺泡受損時,肺不能正常膨脹和收縮,導致肺泡換氣功能降低,患者會感到呼吸不暢,咳嗽或喘息。隨著肺部惡化,許多患者發展肺組織病理變化,引起哮喘或慢性支氣管炎,導致肺氣腫(AAT deficiency,AATD)。
AATD在白種人中發病率較高,美國AATD引起的肺氣腫患者約為8-10 萬人,全球約為65 萬人。目前臨床用AAT藥物完全從人血漿提取,在美國因藥物短缺僅45%左右患者才能用得上該藥物,而且治療費用高達12.7 萬美元/人/年,其市場前景巨大。
(湖北廣電融媒體記者 王丹 責任編輯 謝雅靜)
【來源:湖北網路廣播電視臺】