CaCO3
我叫碳酸鈣,是一種白色難溶固體,是大理石(或者石灰石)的主要成分,我可以做補鈣劑,牙膏中有我,又白又硬的牆壁中也有我,澄清石灰水變渾濁也是因為產生了我。
我的相對分子質量正好是100,Ca相對原子質量是40,所以金屬元素Ca佔40%。
實驗室用大理石和稀鹽酸製取二氧化碳,是由於大理石中有我碳酸鈣。
為啥選含我碳酸鈣的大理石,而不選擇碳酸鈉Na2CO3製取二氧化碳呢?
對呀,碳酸鈉也可以和稀鹽酸製取二氧化碳,為什麼不選他呢?那是因為碳酸鈉總是按捺不住激動的心,一遇到鹽酸就迅速反應,由於速度太快,還沒來的及收集氣體就完事了,那不是瞎折騰嗎?!
大理石和稀硫酸反應也可以產生二氧化碳,但實驗室不採用稀硫酸,為啥?
因為生成的硫酸鈣微溶於水,會覆蓋在大理石表面,阻止反應的進行。
那麼,實驗室製取二氧化碳選用什麼裝置呢?大理石是固體,稀鹽酸是液體,反應條件是常溫,所以發生裝置我們選用固液常溫型。
二氧化碳能溶於水,且與水反應,不能用排水法收集;密度比空氣大,所以可以選用向上排空氣法。
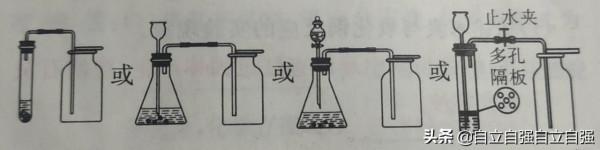
裝置如下圖所示
上面裝置各有優缺點:
第一個裝置優點:裝置簡單,操作方便 第二個裝置優點:方便添加藥品 第三個裝置優點:可以透過控制液體的滴加速率和滴加量來控制反應速率 第四個裝置優點:隨時控制反應的發生和停止
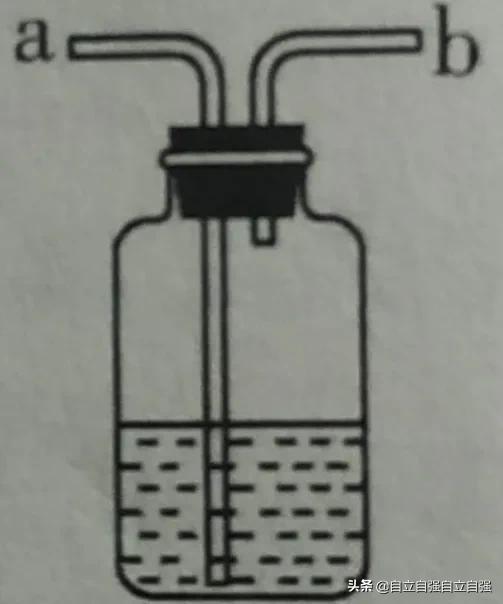
原理是:加緊止水夾,試管內壓強增大,壓迫液體進入長頸漏斗,試管內液麵下降,固體藥品和液體藥品分離,反應停止。
那麼,實驗室製取二氧化碳用大理石和稀鹽酸是絕佳的選擇嗎?!NO!這是因為鹽酸是揮發性液體,尤其是濃鹽酸,所以從發生裝置出來的氣體不純,除了二氧化碳還有氯化氫和水蒸氣。
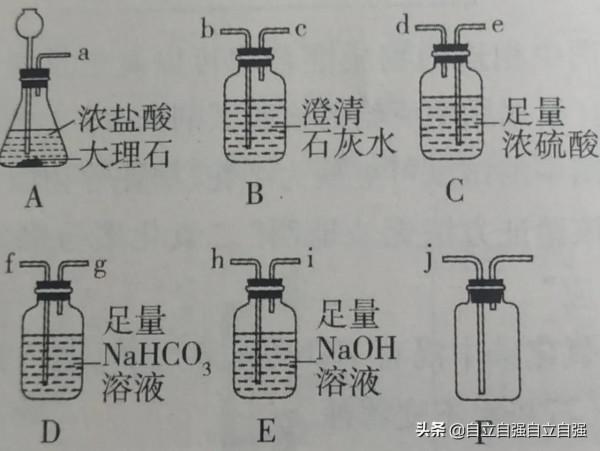
要想得到純淨(除氯化氫)、乾燥(除水蒸氣)的二氧化碳,需要用到以下裝置
萬能瓶裡藥品不同,功能也就不同。裡面是飽和碳酸氫鈉溶液,可以除氯化氫;若是濃硫酸,也可以乾燥氣體;若是澄清石灰水,則可以檢驗二氧化碳……
理解了以上內容,那麼下面這道題就一目瞭然了
利用上述裝置,製取純淨、乾燥的二氧化碳,裝置的連線順序是ADCF
a和b連線,澄清石灰水沒有變渾濁,原因?
二氧化碳中混有氯化氫,會和生成的碳酸鈣反應,所以不變渾濁。
不僅實驗室,工業上也用含我碳酸鈣的石灰石製取二氧化碳。