異檸檬酸脫氫酶1(IDH1)和異檸檬酸脫氫酶2(IDH2)的突變在多種髓系惡性腫瘤中普遍存在。突變型IDH蛋白透過競爭性抑制α-酮戊二酸(α-KG)依賴性雙加氧酶,使細胞分化受阻。在組蛋白和DNA去甲基化中突變型IDH1和IDH2的小分子抑制劑已經被開發出來,在各階段臨床試驗中均有所進展。近日,Nature子刊——《Nature Reviews Clinical Oncology》(影響因子 66.675)發表的一篇綜述詳細介紹了IDH突變的生物學特徵、在各類相關腫瘤中的預後情況、IDH突變靶向藥物治療相關腫瘤的研究資料及針對腫瘤潛在發病機制治療等豐富內容1。正值同類首創IDH1突變抑制劑艾伏尼布即將有望惠及中國AML患者之際,特邀南方醫科大學血液病研究所所長劉啟發教授對急性髓系白血病(AML)中IDH突變相關內容進行精彩解讀與點評!
- 主任醫師,教授,博士生導師
- 南方醫科大學血液病研究院院長、血液病研究所所長
- 南方醫院血液科主任
- 亞太地區血液學會委員
- 中華醫學會血液學分會副主任委員
- 中華醫學會血液學分會感染學組組長
- 中國老年醫學會血液學分會副會長
- 中國研究型醫院學會細胞研究與治療分會副主任委員
- 中國醫師協會血液醫師分會常委
- 廣東省醫學會血液學分會主任委員和細胞治療學會副主任委員
- 廣東省血液腫瘤首席專家
- 從1983年大學畢業後一直從事血液腫瘤的診療和相關基礎研究工作,曾在日本東京自治醫科大學作為客座研究員進行白血病分子生物學研究工作。在白血病的分子發病機理、腫瘤免疫治療、造血幹細胞移植和免疫功能低下人群感染防治等領域做出較大成績。
- 曾先後主持1項國家重點研發計劃,3項863計劃,9項國家自然科學包括重點專案1項和20餘項省部級課題的研究。相關研究成果獲國家科技進步二等獎1項、省部級科技成果一等獎2項和二等獎5項。
- 在國內外核心期刊發表論文200餘篇包括:Lancet Oncol, JCO,PNAS, Blood 和Leukemia等SCI期刊100餘篇。
核心要點
• IDH1或IDH2突變導致代謝產物D-2-羥基戊二酸(D-2HG)的產生積聚,對AML的細胞表觀遺傳學、分化模式和代謝概況具有深遠影響。
• IDH突變的發生率、早發性及其突變蛋白在AML細胞中的一致表達,使其在AML中成為一個極具吸引力的治療靶點。
• 突變IDH1和IDH2在AML發生和發展中的作用可能是短暫或動態的,且與環境相關。
• 疾病復發時的IDH突變狀態可以為了解復發機制提供思路。在AML中,突變的IDH1或IDH2受到抑制後會產生恢復D-2HG生成的耐藥性突變。
AML中IDH突變的生物學特性
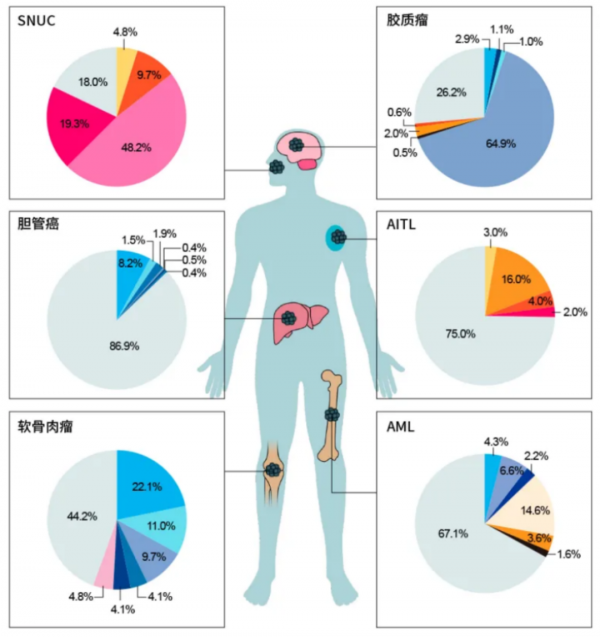
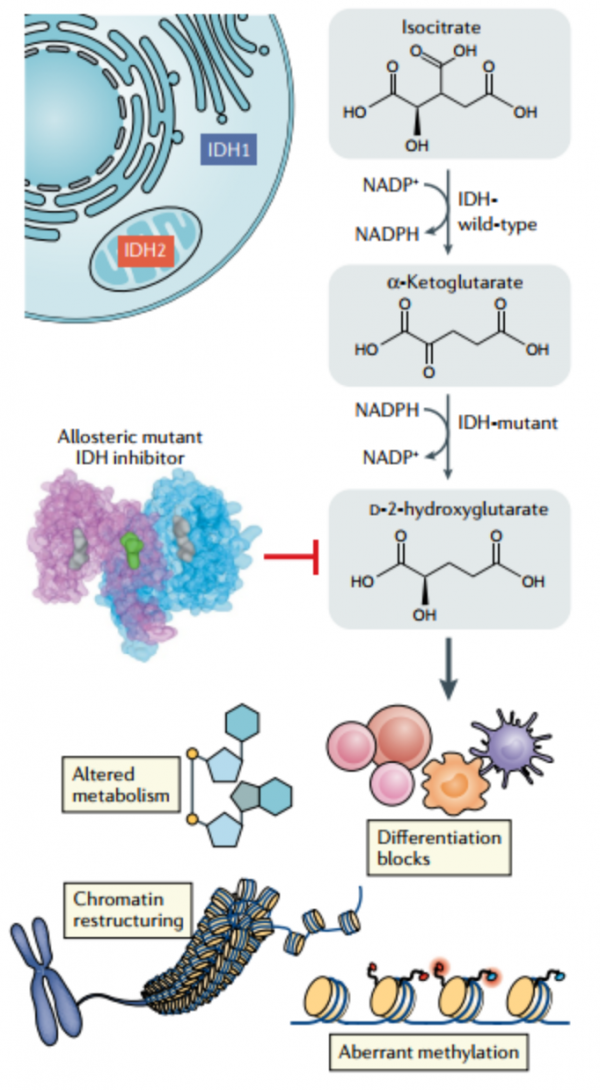
約20%的AML患者存在IDH1(R132C和R132H)或IDH2(R172和R140)體細胞突變(圖1)。IDH突變酶新的活性是將α-KG轉化為代謝產物D-2HG,該過程消耗NADPH,生成NADP+。雜合子狀態是D-2HG產生的必要條件,而IDH突變幾乎都是雜合的。酶複合物中突變IDH亞基的存在有利於封閉構象,並賦予NADPH高親和力,可將α-KG還原為D-2HG。IDH突變致病的確切機制仍不清楚,但D-2HG和α-KG的結構相似性導致了競爭性抑制。因此,在IDH突變AML中,利用α-KG作為底物的通路受到干擾,導致組蛋白和DNA甲基化、染色質重塑、細胞分化阻斷和其他轉化效應的表觀遺傳失調。
AML中IDH突變抑制劑的發展
IDH突變常發生在AML早期,在細胞中特異性表達,由此其成為引人注目的治療靶點。IDH突變小分子抑制劑、IDH突變定向免疫療法和靶向IDH突變誘導的代謝障礙藥物是當下的研究熱點。
IDH突變獨特的結構和功能特徵促進了小分子抑制劑的發現(圖2)。AGI-5198是第一個有效抑制IDH1突變的分子,在其體外試驗中觀察到D-2HG的產生減少90%,但其整體藥代動力學和藥效學特性使其未能成功進入臨床應用。
經過一系列的化學最佳化後產生了具有更好藥理特性的IDH1突變抑制劑(艾伏尼布,也被稱為AG-120)、IDH2突變抑制劑(Enasidenib,AG-221)以及IDH1和IDH2突變的雙重抑制劑(Vorasidenib,AG-881)。這些抑制劑透過與變構位點結合並阻止催化所需的構象變化,將突變酶穩定在開放的非活性構象。
IDH突變型AML
01 預後及生物學
AML是成人中最常見的急性白血病,其特徵是低分化髓系細胞不受控制的增殖進而導致未成熟的髓系細胞或原始細胞累積。AML患者5年總生存(OS)率約為40-50%,不過預後會隨年齡增加以及復發和/或難治性(R/R)疾病的出現而逐漸變差,5年OS率可降低至5-10%。
一項納入33項研究資料、涉及12747例AML患者的薈萃分析闡明瞭IDH突變的預後價值。與IDH野生型患者相比,IDH-1突變型AML患者亞群的OS(HR 1.17;95% CI 1.05-1.31)和無事件生存(EFS)率(HR 1.29;95% CI 1.07-1.56)更差,且完全緩解(CR)率更低(RR 1.21;95%CI 1.02-1.44)。有趣的是,儘管IDH2-R172突變患者的CR率較低(RR 2.14;95%CI 1.61-2.85),但IDH2(R172和R140)突變患者的OS表現出有利的趨勢(HR 0.78; 95% CI 0.66–0.93)。雖然這項分析較為全面,並認可這些研究之間的異質性,但其他研究並沒有發現IDH突變對AML預後的影響。這些差異可能反映了患者群體的差異、共突變的作用或選擇用於分析的遺傳亞群的差異。
02 IDH抑制劑治療
艾伏尼布(IDH1抑制劑)
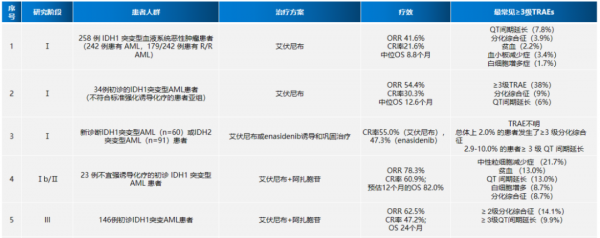
單藥治療R/R AML:一項艾伏尼布單藥治療IDH1突變型AML患者的I期研究納入了258例IDH1突變的血液系統惡性腫瘤患者,其中179例患者為R/R AML。儘管20.7%的患者發生了≥3級TRAE(最常見的是QT間期延長[7.8%]、分化綜合徵[3.9%]和血小板計數下降[3.4%]),但艾伏尼布總體耐受性良好。在125例每天接受500 mg艾伏尼布並至少隨訪6個月的R/R AML患者中,客觀緩解率(ORR)為41.6%,CR+伴部分血液學恢復的CR(CR/CRh)率為30.4%,CR率為21.6%,中位OS為8.8個月,達到CR或CRh患者的中位OS未達到(中位隨訪時間為14.3個月),除CR或CRh外,達到客觀緩解患者的中位OS為9.3個月,而無緩解患者的中位OS僅為3.9個月。此外,21%的CR或CRh患者在一個或多個時間點清除了骨髓單核細胞(BMMC)的IDH1突變,且這一特徵與較好的緩解有關:25例CR患者中有28%實現了IDH1突變清除,而未達到CR的患者則沒有。這些發現為FDA批准艾伏尼布治療IDH1突變的R/R AML患者奠定了基礎。
單藥治療初診AML:一項艾伏尼布單藥治療初診的IDH1突變型AML患者的I期研究納入34例患者,在不符合標準強化誘導化療的患者亞組中,≥3級TRAE的發生率為38%,分化綜合徵的發生率為9%,QT間期延長的發生率為6%。CR/CRh率為42.4%(CR率為30.3%),ORR為54.5%,中位OS為12.6個月。對其中30例患者進行了IDH1 VAF縱向評估,在64.3%的CR或CRh患者中觀察到BMMC的突變清除,而在沒有達到CR或CRh的患者中觀察到的突變清除率為0%(P<0.001)。這些資料支援FDA批准艾伏尼布作為這部分患者的一線治療。儘管佇列規模較小,但這些資料表明,與R/R AML患者相比,初診的AML患者對艾伏尼布的反應更好。因此,艾伏尼布治療的時機和獲益人群選擇也非常重要。
聯合化療治療初診AML:一項艾伏尼布或Enasenib聯合誘導和鞏固化療治療初診的IDH突變AML患者的I期臨床研究觀察到聯合方案的TRAE與單藥治療相似,在接受艾伏尼布治療的60例患者和接受Enasidenib治療的91例患者中,誘導治療結束時的CR率分別為55%和47%,CR/CRh率分別為72%和63%,使用這兩種藥物治療原發AML患者的總體緩解情況比繼發性AML患者更好。39%的CR或CRh患者清除了BMMC中的IDH1突變,23%清除了IDH2突變。兩個治療組的12個月OS率均超過75%,優於其他研究中的資料,在老年患者中這一優勢更加明顯。因此,突變IDH抑制劑聯合強化誘導化療和鞏固化療是IDH突變AML患者一種有前景的治療方法。
聯合去甲基化藥物治療初診AML:一項治療初診的IDH1突變型AML患者的I/II期試驗顯示,艾伏尼布聯合阿扎胞苷可誘導白血病細胞分化和細胞凋亡,ORR為78.3%,CR率為60.9%。這些有前景的研究結果促進了艾伏尼布聯合阿扎胞苷與安慰劑聯合阿扎胞苷對比的III期AGILE試驗(NCT03173248)開展。
AGILE研究在2021年12月的ASH會議上公佈了最新進展,這是一項評估艾伏尼布聯合阿扎胞苷一線治療初診IDH1突變AML患者的關鍵III期臨床研究,其結果顯示,與安慰劑聯合阿扎胞苷相比,艾伏尼布聯合阿扎胞苷可顯著改善EFS(HR=0.33,P=0.0011),降低患者緩解後復發、進展或者死亡風險67%,顯著延長OS(24.0個月 vs 7.9個月,P=0.0005),顯著提高CR率(47.2% vs 14.9%,P<0.0001)、CR/CRh率(52.8% vs 17.6%,P<0.0001)和ORR(62.5% vs 18.9%,P<0.0001),患者的疾病緩解轉化為生存獲益,所有亞組在EFS和OS上獲益一致,且感染髮生率明顯更低(28.2% vs 49.3%),未發生治療相關的死亡。
聯合BCL-2抑制劑治療R/R AML:艾伏尼布聯合維奈克拉用於IDH1突變血液系統惡性腫瘤患者的I/II期試驗正在進行(NCT03471260),在R/R AML患者中有望觀察到有前景的初步療效和安全性。事實上,隨著越來越多的臨床前和臨床研究資料的積累,開發利用IDH突變的療法將落到實處。
Enasidenib(IDH2抑制劑)
Enasidenib是從先導化合物AGI-6780最佳化而來,是一種口服、選擇性且有效的IDH2抑制劑,能夠降低D-2HG水平,逆轉組蛋白甲基化模式,且在體外和體內AML模型中均能誘導細胞分化。在移植了IDH2-R140Q 突變的人AML原代細胞的小鼠中,該藥物具有良好的耐受性,並將移植細胞中的胞內D-2HG水平降低到可檢測的限度以下,且移植細胞開始表達分化標誌物,包括CD11b、CD14、CD15和CD24。第38天,>60%的人AML細胞已經分化。相應地,表達KIT的未成熟人AML細胞減少,AML原始細胞比例減少2-35倍。
未來研究的方向
分化阻滯是IDH突變型AML的一致特徵,IDH突變抑制劑能有效誘導分化。然而,使用IDH突變抑制劑很少觀察到細胞凋亡和細胞死亡,這突出了聯合治療對最大治療獲益的重要性。此外,IDH突變發生在AML發病早期,但目前的大多數試驗都是在晚期疾病患者中進行,鑑於D-2HG隨著腫瘤演變而有所變化,因此IDH靶向治療時機的探索也至關重要。
專家點評
IDH1作為代謝酶的功能早先被大眾熟知,但其在腫瘤中的突變情況很長一段時間一直未被發現。直到2008年IDH1突變驅動腫瘤進展才第一次進入人們的視野2,此後多項研究表明AML患者存在IDH1突變3,且與不良預後相關:與IDH野生型患者相比,IDH1突變型AML患者亞群的OS和EFS率更差,CR率更低。IDH1突變參與AML的發生發展,不僅對AML有預後提示作用,也可作為AML的治療靶點。
艾伏尼布是全球首款廣泛應用於臨床的靶向IDH1突變的小分子抑制劑,在既往治療IDH1突變AML患者的多項研究中取得顯著療效。
對於初診IDH1突變AML患者群體來說,艾伏尼布不僅單藥治療的良好療效及安全性在AG120-C-001臨床研究中有所體現4,與阿扎胞苷聯合方案在一項Ⅰb期研究同樣顯示良好的安全性和有效性5,且在剛召開的ASH年會上報道的III期研究AGILE中得到了進一步驗證6,而評估艾伏尼布與標準誘導和鞏固治療聯合方案的AG120-221-C-001Ⅰ期研究中,CR+不完全血液學恢復(CRi)/不完全血小板恢復(CRp)緩解率和1年OS率均顯示令人鼓舞的資料7。
而對於R/R IDH1突變AML患者,艾伏尼布的有效性已在一項多中心、單臂、開放標籤的I期臨床試驗(AG120-C-001)中得到證實4,中國IDH1突變的R/R AML患者的首個橋接註冊試驗——CS3010-101研究結果也顯示了其優異的療效和良好的安全性。
基於以上這些突破性的臨床試驗結果,艾伏尼布已在國外被批准廣泛應用於IDH1突變AML患者,很高興看到艾伏尼布有望在國內臨床實踐中也用於治療攜帶IDH1突變的成人復發或難治性AML患者。期待研究者們不斷挖掘 IDH1突變相關的治療策略潛力,豐富AML患者的治療選擇。
參考文獻:
1. Pirozzi CJ, Yan H. The implications of IDH mutations for cancer development and therapy. Nat Rev Clin Oncol. 2021 Oct;18(10):645-661.
2. Parsons DW, et al. An integrated genomic analysis of human glioblastoma multiforme. Science. 2008;321(5897):1807-1812.
3. Mardis ER, et al. Recurring mutations found by sequencing an acute myeloid leukemia genome. N Engl J Med. 2009 Sep 10;361(11):1058-1066.
4. Roboz GJ, Dinardo CD, et al. Blood,2020, 135(7): 463-471.
5. DiNardo CD, et al. Mutant Isocitrate Dehydrogenase 1 Inhibitor Ivosidenib in Combination With Azacitidine for Newly Diagnosed Acute Myeloid Leukemia. J Clin Oncol. 2021 Jan 1;39(1):57-65.
6. Pau Montesinos, et al. Oral on ASH 2021 (697). https://ash.confex.com/ash/2021/webprogram/Paper147805.html
7. Eytan M. Stein, et al. Poster on ASH 2021 (1276). https://ash.confex.com/ash/2021/webprogram/Paper146507.html
NPM-CN-HEMA-013-20230112