新年新氣象,製藥巨頭們又紛紛對體內細胞和基因編輯療法“打起了主意”,在1月10日就有3項大額合作達成,輝瑞、拜耳青睞體內鹼基編輯、CRISPR基因編輯療法,Moderna則邁向了體內CAR-M(嵌合抗原受體巨噬細胞)療法的開發。下面我們來詳細介紹這三項合作:
輝瑞押注體內鹼基編輯療法
輝瑞與Beam Therapeutics將進行罕見疾病的體內鹼基編輯療法的開發合作。
這項合作為期4年,將針對肝臟、肌肉和中樞神經系統罕見遺傳疾病的3個靶點進行體內鹼基編輯療法的開發。Beam將收到3億美元的預付款,未來的里程金將有可能高達10.5億美元。
Beam由David Liu、張鋒和Keith Joung創辦於2017年,鹼基編輯技術來源於David Liu實驗室。
Beam的三位創始人:(左起)張鋒、David Liu、Keith Joung(來源:Beam)
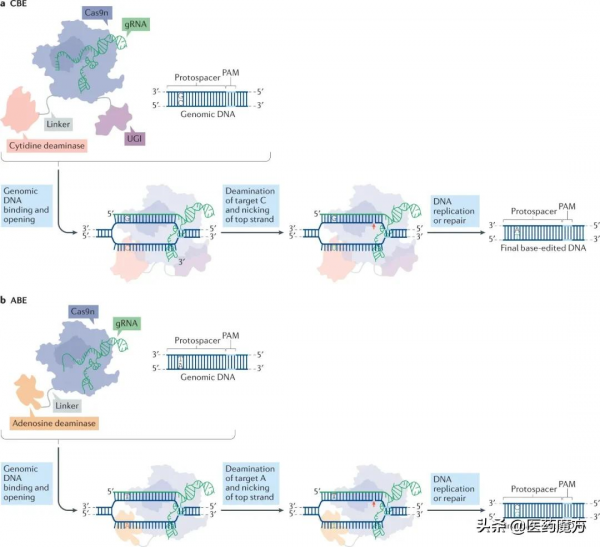
鹼基編輯是一種更為精確的基因編輯,鹼基編輯最主要的優勢是不需斷裂DNA雙鏈即可完成編輯。目前應用比較廣泛的DNA鹼基編輯器主要為胞嘧啶鹼基編輯器(CBE)和腺嘌呤鹼基編輯器(ABE)這兩類。CBE編輯的是C·G到T·A鹼基對的轉化,ABE編輯的是A·T到G·C鹼基對的轉化。
DNA鹼基編輯技術概覽(來源:Nature Reviews Drug Discovery)
拜耳心繫體內CRISPR基因編輯療法
拜耳與Mammoth Biosciences達成的體內基因編輯療法合作的重點將是肝臟靶向疾病。
根據協議條款,Mammoth將獲得4000萬美元的預付款,並有可能獲得超過10億美元的里程金。此外,拜耳將支付研究經費和分層版稅,最高可達淨銷售額的兩位數百分比。
Mammoth成立於2017年,2020年諾貝爾化學獎得主Jennifer Doudna是Mammoth的聯合創始人之一。
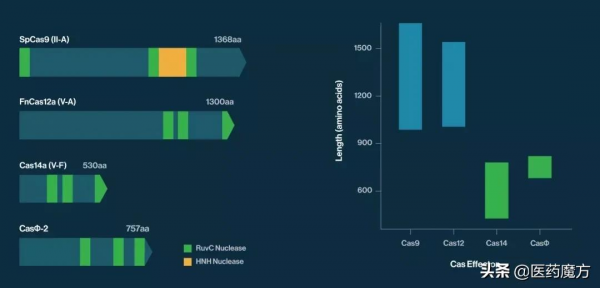
Mammoth的CRISPR平臺專注於兩種超小型Cas酶:Cas14和Casɸ,Cas酶是CRISPR基因編輯系統的核心元件。基因編輯器常用的遞送工具是腺相關病毒(AAV),但是AAV的負載量有限,所以更小尺寸的Cas酶更易遞送,並且有希望增加體內基因編輯的範圍。拜耳在此次合作協議中獲得了這種新型基因編輯技術的使用權。
Cas14和Casɸ與常用的Cas9和Cas14的比較(來源:Mammoth)
Moderna率先入局體內CAR-M療法
Moderna與CarismaTherapeutics未來將共同開發用於治療癌症的體內CAR-M療法。
Carisma的技術來源於創始人Michael Klichinsky和Saar Gill的實驗室。2014年,Michael Klichinsky在賓夕法尼亞大學Perelman醫學院的Saar Gill和Carl June的實驗室裡進行博士論文研究時,發現了一種對患者巨噬細胞進行基因改造的方法,能使巨噬細胞在消滅癌細胞的同時不會損傷正常組織。兩年後,Klichinsky和Gill共同創立了Carisma,希望能充分實現工程化巨噬細胞治療實體瘤和其它嚴重疾病的潛力。
Michael Klichinsky(左)和Saar Gill(右)博士(來源:Carisma官網、Perelman醫學院)
Carisma開發的CAR-M透過靶向腫瘤細胞表面的特定標記物來治療乳腺癌、肺癌和卵巢癌等常見的實體瘤。此次合作將結合Carisma的工程巨噬細胞技術與Moderna的mRNA和脂質奈米顆粒(LNP)技術來開發體內CAR-M療法。
根據協議條款,Carisma將獲得4500萬美元的預付款和3500萬美元的投資,未來將獲得研究資金,並有資格獲得開發、監管和商業里程金,以及根據合作商業化的任一產品的淨銷售額版稅。Carisma將負責候選藥物的發現和最佳化,Moderna有權選擇多達12個靶點進行臨床開發和商業化。
體內改造代表著未來方向嗎?
此前我們就體內基因編輯技術的困境與優勢做過分析(戳這裡回顧),目前基因編輯技術大多數應用於體外細胞的編輯中,即從患者體內採集的細胞在體外進行基因編輯後,再作為治療藥物重新注入患者體內。
需要注意的是,體外基因編輯能應用的細胞類型範圍較窄,雖然像造血幹細胞這類細胞在體外進行基因改造後的存活率很高,但是有些細胞經基因改造後存活率很低或者無法存活,神經元就是最典型的細胞型別,它會在基因編輯後死亡或在後期培養中失去功能。所以體外基因編輯可能並不適用於一些神經系統遺傳疾病。
而體內基因編輯是直接在體內細胞中進行基因編輯的技術,目前雖然風險較高,但是如果成功,就意味著擁有更多的靶細胞和靶器官,更多的目標適應症。
再來看體內細胞療法,就目前比較熱門的嵌合抗原受體細胞療法(CAR-T、CAR-NK、CAR-M…)來說,傳統的開發方式是將從患者體內提取的細胞進行體外改造,使其能夠表達靶向特定抗原的CAR,然後注入患者體內進行治療。
橫在這類細胞療法面前的一個巨大障礙是,CAR細胞療法是個性化的,這不僅意味著療法的生產週期長,而且相應的,療法的價格也十分昂貴。
此前同種異體(也稱現貨型)細胞療法的開發為細胞療法未來的發展打開了一個新視窗,現在,又有一個新視窗打開了:體內CAR-T、CAR-M療法。
在1月6日的Science封面論文中,mRNA疫苗技術先驅Drew weissman的研究團隊就為我們帶來了利用mRNA開發體內CAR-T細胞療法的突出結果,利用mRNA和LNP技術產生的治療性CAR-T細胞能夠成功減少疾病小鼠模型的纖維化,並能恢復小鼠的心臟功能(推薦閱讀:體內CAR-T來了!Science封面報道:注射mRNA直接生成CAR-T,有效修復心臟功能)。
而Moderna利用mRNA和LNP技術在體內CAR-M療法上的率先嚐試也為體內細胞療法型別的進一步擴充套件帶來了新的希望。
參考資料:
[1] Pfizer and Beam Enter Exclusive Multi-Target Research Collaboration to Advance Novel In Vivo Base Editing Programs for a Range of Rare Diseases(來源:businesswire)
[2]Porto, E.M., Komor, A.C., Slaymaker, I.M. et al. Base editing: advances and therapeutic opportunities. Nature Reviews Drug Discovery (2020)
[3] Bayer and Mammoth Biosciences to Collaborate on Novel Gene Editing Technology(來源:businesswire)
[4] Moderna and Carisma Establish Collaboration to Develop in vivo Engineered Chimeric Antigen Receptor Monocytes (CAR-M) for Oncology(來源:PR Newswire)