在第四屆免疫治療及伴隨診斷合作峰會上,一項有關“腫瘤新藥研發如何走出過分內卷困境”的演講中,恆瑞醫藥全球研發總裁張連山提出兩個重要方向:一個是發現新靶點和探索全新適應症,另一個是基於多組學分析的創新生物標誌物研究。
而這兩個方向恰好契合了裕泰抗原(以下簡稱裕泰)的定位。2015年,專注於腫瘤免疫領域精準診斷的裕策生物成立,3年後,成立全資子公司裕泰。裕泰的誕生,與腫瘤免疫治療領域尤其是腫瘤疫苗的進展息息相關。
新生抗原是腫瘤免疫領域中非常重要且前沿的方向之一,也是腫瘤疫苗開發的靶點基礎。這是裕泰成立後一直有所積累的方向。裕泰在與新藥研發行業的深入接觸中,也關注到中國臨床前開發和臨床開發脫節的問題,逐步將業務拓展到轉化研究CRO服務上,最終奠定其以新生抗原靶點開發+基於組學資料的創新biomarker開發為引擎的兩大發展方向。
提高新生抗原預測的準確性
新生抗原的預測與鑑定一直是裕泰賴以立足的“器”,也是其最初的市場切入點。
據裕泰抗原總經理兼裕策生物高階副總裁蘇小凡介紹,預測準確率較低一直是新生抗原臨床開發面臨的最大挑戰。
從產生基因突變,到抗原肽的表達、遞呈、結合,新生抗原的生物學路徑非常複雜,而只有能夠被T細胞識別、引起免疫原性的,才被視作有意義的新生抗原。這樣的突變才可作為免疫治療的靶點。
由於無法從實驗的角度去模擬、還原這個複雜的生物學過程,要從大量的突變中篩選出有免疫原性的抗原肽就顯得非常困難,這也導致行業整體預測準確性不高,難以轉化出可臨床應用的下游療法。
當前佈局新生抗原預測的企業不少,大多是匯入腫瘤全外顯子測序(WES)及轉錄組測序(RNA-seq)等高通量測序資料,然後基於各家演算法進行篩選和體外驗證。
測序的手段差別並不大,差異化主要體現在後續的篩選和驗證上,這是對最後預測準確率產生影響的重要環節。後續的篩選和驗證也是裕泰的關注點,體現在對其開發的TruNeo演算法平臺的不斷迭代與打磨上。
裕策生物成立當年,即開發出TruNeo這一演算法,較同行更早佈局這一領域。相比其他的演算法,TruNeo納入更多新生抗原產生的要素和通路,包括多肽MHC結合親和力、蛋白酶體剪下、抗原轉運蛋白(TAP)轉運效率、抗原表達丰度、腫瘤異質性、克隆性和HLA LOH(雜合性缺失)等。
據瞭解,裕策生物還透過旗下醫檢所的臨檢業務以及與PI合作佇列研究建立了新生抗原資料庫,並於2019年引入了神經網路深度學習演算法。在平臺中不斷匯入經體外驗證過的真實世界或佇列研究的資料,催生演算法迭代,嘗試透過這樣的方式進一步提升新生抗原預測的準確性。
目前,TruNeo對腫瘤新生抗原的預測準確率可以達到40%~50%,高於國內行業平均水平。
事實上,裕策生物不僅是國內較早佈局新生抗原預測領域的企業之一,亦是最早進入國際腫瘤新生抗原篩選聯盟(TESLA)的國內企業。
TESLA(Tumor Epitope SeLection Alliance)由美國癌症研究院(CRI)、帕克癌症免疫治療研究所(PICI)聯合紀念斯隆凱特琳癌症中心(MSKCC)、MD安德森癌症中心等30多家研究機構和企業組成,主要構建新生抗原預測演算法評價與改進的基準,以對各成員預測結果的準確性進行評估。

裕策生物多次參加聯盟內的演算法評價專案,在取得共識的評價流程下,達成對預測準確性、國際同行位置更清晰、更客觀的認知和評價,在最近一次評價中,TruNeo對新生抗原預測的敏感性達到87.5%,在所有參評團隊中位居第一位,預測結果中Top10肽段的驗證率達40%,位居所有參評團隊的第四位。
在不斷最佳化TruNeo演算法的同時,新生抗原的產業化也是裕策生物的關注點,裕泰的成立就是向新生抗原產業化方向的佈局。
據蘇小凡介紹,基於TruNeo演算法,裕泰已與逾10家臨床機構達成合作,共同開發基於新生抗原的腫瘤疫苗/細胞療法,並向十多家藥企提供了新生抗原預測或驗證服務,其中不乏國內一線雙抗藥物開發的biotech公司。
裕泰與華西醫院魏於全院士團隊合作開發的個性化新生抗原DC 疫苗臨床試驗是較為典型的例子。在這項由研究者發起的臨床試驗中,12位接受5劑疫苗注射的晚期難治型非小細胞肺癌患者中,6 例(50%)靶病灶縮小,9 例(75%)疾病得到控制,3 例(25%)出現疾病進展,中位無進展生存期(mPFS)為5.5個月,中位總生存期(mOS)為7.9個月。相關成果已經發表在Signal Transduction and Targeted Therapy雜誌上。
biomarker開發的閉環
2017年,裕策生物聯合中國工程院院士詹啟敏發起了“天梯計劃”。這是國內首個針對腫瘤免疫治療的佇列研究合作計劃,旨在透過對納入佇列研究的腫瘤患者的組學資料及臨床資料進行整合式分析,發現腫瘤免疫領域潛在的新靶點和biomarker。
彼時中國尚沒有腫瘤免疫療法獲批。追蹤同時期國外腫瘤免疫藥物研發進展時,裕策生物管理層敏銳地意識到,免疫治療的複雜性決定了其biomarker的開發較靶向治療更為複雜,將很難找到“one-fit-for-all”的生物標誌物。這是他們啟動“天梯計劃”的原因。
“天梯計劃”也成為裕泰佈局轉化研究和創新biomarker開發的基石。2020年,裕泰的業務版圖納入創新biomarker開發,確立其雙輪驅動模式。
蘇小凡表示,在腫瘤免疫領域,biomarker呈現的模式有別於靶向治療。
在靶向治療中,biomarker與治療靶點有較大的相關性,依靠分子診斷和免疫組化基本可以達成檢測的需求。而在腫瘤免疫中,影響的因素既有基因組層面的,也有腫瘤免疫微環境層面的。在免疫聯合化療、免疫聯合小分子等聯合治療成為開發趨勢後,需要考慮的因素則更多。較為全面、綜合的多組學技術平臺是腫瘤免疫biomarker開發非常關鍵的能力之一。
搭建多組學技術平臺也是裕泰2020年投入精力最多的工作。裕泰選擇參照NCI癌症登月計劃旗下CIMAC-CIDC網路(Cancer Immune Monitoring & Analysis Centers and Cancer Immunologic Data Commons Network)推薦的1st Tier Assays來搭建多組學平臺。
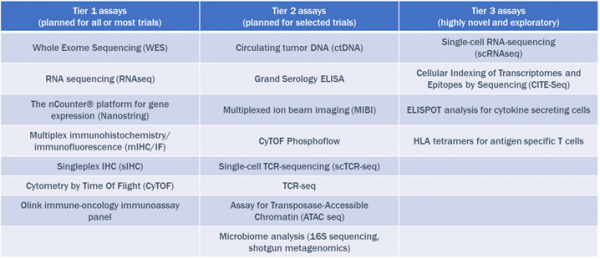
最終搭建完成的平臺跨越基因組學、轉錄組學兩個維度,既有傳統的組化/病理平臺,也兼顧了前沿的空間表達譜/單細胞測序平臺。其中,包括從美國NanoString公司引進DSP(Digital Spatial Profiler)空間表達譜平臺,從瑞典Olink公司引進Olink超高靈敏度微量蛋白檢測平臺這兩個較為前沿的平臺。
同時,針對已有的免疫組化平臺,裕泰投資近千萬進行了軟硬體升級,新購置了Akoya Biosciences的Phenoptics定量病理及微環境分析平臺,而且為其配備了知名的病理影象分析軟體HALO。
在蘇小凡看來,依託於多組學資料進行biomarker開發第二個核心能力是資料的分析和處理能力。
裕策生物的核心創始團隊皆具有生物資訊背景,裕泰又整合了裕策的生物資訊團隊中的精英成員。除了組學資料中常見的基因組、表達譜資料,生物資訊團隊也在搭建針對IHC及mIF等影象資料的數字病理分析流程,可結合臨床資訊進行多維度的佇列分析。
而由多組學資料、整合式分析和臨床驗證佇列構成的biomarker開發閉環中,“天梯計劃”扮演了驗證的關鍵角色。據瞭解,截至目前“天梯計劃”已積累4000多例患者的組學資料及臨床資訊,涵蓋中國人群高發的肺癌、胃癌、腸癌、肝癌等十幾種類型,且仍在不斷積累中。
回到具體的biomarker開發,針對比較成熟、已獲得驗證的腫瘤免疫biomarker,如腫瘤突變負荷(TMB)、微衛星不穩定(MSI)等基因組標誌物,裕泰的差異化策略主要是藉助其新生抗原的研究成果,在探針設計時提高對富集新生抗原的高頻區域的覆蓋深度,並增加對HLA LOH(雜合性缺失)的檢測,提高TMB檢測的準確率。
更重要的在於面向創新biomarker的發掘。目前,裕泰在探索中的創新biomarker已有40餘個,這些biomarker分佈於不同層面上,包括基因組層面的瘤內異質性(ITH)、新生抗原負荷(TNB),也包括基於免疫組化開發的一些新的蛋白靶標。
其中,進展比較快的是與中山大學腫瘤防治中心張力教授、方文峰教授團隊共同開發的ITH指標。
裕泰在七十多例患者的肺癌免疫治療小佇列中發掘、構建起這一模型,並在兩千多例患者的公開資料中驗證該指標與免疫治療的相關性,發現ITH或可在肺癌中作為接受抗PD-1/PD-L1治療的預測性生物標誌物,並具有泛腫瘤標誌物潛力,尤其是低TMB人群及TMB預測價值不佳的瘤種,如鼻咽癌、透明腎細胞癌等。研究資料已於今年初發表在Molecular Cancer 雜誌上。
蘇小凡告訴研發客:“學術界已經有多篇重磅文章明確了在免疫治療應用中, TMB結合ITH是更精準的biomarker。突變負荷代表突變的數量,瘤內異質性代表的就是突變的質量——這個突變是發生在主克隆還是亞克隆上,不同的克隆來源對免疫治療的影響是很不一樣的。所以,我們認為把這兩個指標結合在一起,或有可能成為基因組層面最佳的腫瘤免疫biomarker。我們現在正在積極推進TMB與ITH相結合的診斷方法開發。“
商業化邏輯與未來發展三個階段
實際上,新生抗原和創新biomarker開發這兩塊業務思路上有一些差別,但業務的合併卻有一個成熟的商業邏輯支撐。
“裕泰做的事情是CRO裡一個比較細分和小眾的方向。主營業務雖然分了兩個方向,但底層商業邏輯及所依託的實驗技術平臺其實是相通的:多組學技術平臺產生大量的組學資料,透過關聯藥物療效資訊發現的一些突變或蛋白訊號,可能成為預測藥物療效的生物標誌物,也可能因為與治病機理的相關性成為潛在的藥物靶點。”蘇小凡說。
因此,裕泰未來的發展將更多聚焦在腫瘤免疫微環境中創新靶點和生物標誌物的開發,同步進行早期的專利佈局,透過靶點的license out或者是合作開發實現商業化。
蘇小凡進一步表示,除了上述依賴自身創新成果的商業模式,公司也有轉化研究CRO服務的佈局。
一方面,專注於早期臨床和臨床前轉化研究的CRO非常少,有遠未滿足的客戶需求,也就意味著不小的商業機會。另一方面,裕泰接觸的均是有創新藥研發能力和管線的biotech或biopharma公司,服務模式下如能幫助客戶找到有價值的療效預測標誌物,後續或有聯合開發伴隨診斷產品的商業機會。
最後,蘇小凡介紹了裕泰對於未來發展的規劃。
從現在到2023年是公司發展的第一階段,重點突出轉化醫學研究能力。這個階段中,國內大量免疫治療藥物處於早期臨床開發階段,裕泰保持與藥物臨床開發的一致節奏,藉助對腫瘤免疫biomarker和新生抗原的理解,結合臨床佇列療效資料,進行反向轉化,探索影響藥物療效的潛在原因。
中心實驗室的建立、技術平臺的執行、前中後臺團隊間的磨合都會在這個階段集中完成。靶點開發方面,計劃在2023年之前進行腫瘤免疫新靶點的專利佈局,目標是公示中或取得專利號的專利超過40項。
2023~2025年是公司進入產品化能力建設的階段。在這個階段,裕泰預設了兩個方向的里程碑:第一,伴隨診斷方向,預計會有多個腫瘤免疫領域的伴隨診斷產品與藥物同步進入到臨床驗證階段,也就是與藥物共同提交IND申請;第二,創新靶點的產品化方向,無論下游對接的是mRNA疫苗、雙抗還是細胞療法,透過授權或組建合資公司的方式去合作開發治療性產品,爭取把靶點專利具象化,走通這方面的商業模式。這一方向上涉及的利益方更多,合作模式也更復雜,需要更多摸索。
2025年之後則進入第三階段,在伴隨診斷、靶點開發兩個方向上全面實現商業化的能力。
總第1502期