引用本文: 李曉俊, 李亞, 卞晴晴, 等. 中西醫結合治療對慢性阻塞性肺疾病痰熱證急性加重-穩定期大鼠免疫因子的影響研究 [J] . 中國全科醫學, 2022, 25(2) : 197-205. DOI: 10.12114/j.issn.1007-9572.2021.01.044.
慢性阻塞性肺疾病(COPD)急性加重期(AECOPD)是COPD管理中的重要事件,嚴重影響患者的健康狀況、疾病進展和住院/再入院率[1]。COPD患者氣道表面普遍存在分泌型免疫球蛋白A(sIgA)缺損[2],與氣流阻塞的嚴重程度相關[3,4]。sIgA介導宿主保護和病原體中和[5],位於免疫系統抵禦病原體的第一道防線。人體胃腸道與呼吸道具有典型的黏膜結構,均能分泌大量sIgA,並透過歸巢遷移及共同免疫系統相聯絡,成為肺與大腸相關性的重要基礎[6]。COPD患者肺間質及實質等組織活檢[7]發現大量T淋巴細胞聚集現象,表現為CD8+細胞數量增加,CD3+和CD4+細胞數量基本不變或稍降,CD4+/CD8+下降,導致免疫失衡[8],是COPD發生和發展的關鍵因素[9,10]。中西醫結合治療COPD可以顯著改善患者症狀、減少併發症、改善肺通氣功能、降低致殘率等[11,12],但中西醫結合治療COPD痰熱證急性加重-穩定期對肺組織和腸組織的sIgA、CD3+及CD4+的影響缺乏相關證據。本研究透過觀察中西醫結合治療對COPD痰熱證急性加重-穩定期大鼠的用力肺活量(FVC)、第0.3秒用力呼氣容積(FEV0.3)、FEV0.3/FVC以及肺、腸組織的sIgA、CD3+和CD4+水平產生的影響,明確中西醫結合治療對肺組織和腸組織的免疫屏障功能的修復作用,以期為COPD的中醫藥診治提供新思路。
1 材料與方法
1.1 實驗動物
2019年9月至2020年12月選取SPF級SD大鼠60只,雌雄各半,體質量(200±20)g,購於濟南朋悅實驗動物繁育中心〔許可證號:SCXK(魯)2019-0003〕。
1.2 香菸
紅旗渠牌過濾嘴香菸,硬金紅,烤煙型,焦油量10 mg,菸鹼量1 mg,煙氣一氧化碳含量12 mg,河南中煙工業有限責任公司生產。
1.3 藥物
脂多糖(LPS,100 mg,Sigma,USA,使用前用0.9%氯化鈉溶液溶解為1 mg/ml)。0.9%氯化鈉溶液(500 ml/瓶,河南竹林眾生製藥股份有限公司)。通塞顆粒(TSG,藥物組成為葶藶子15 g、地龍15 g、赤芍12 g、川貝母10 g、生曬參10 g、麥冬15 g、炙麻黃9 g、制大黃6 g、石菖蒲10 g,由河南中醫藥大學藥學院中藥製劑實驗室鑑定提供,專利號:ZL201010183177.1)。補肺益腎方(BYG,藥物組成為黃芪15 g、黨參9 g、枸杞子12 g、浙貝母9 g、山茱萸12 g等,製成流浸膏備用,含生藥量1.848 g/ml,由河南中醫藥大學藥學院中藥製劑實驗室鑑定提供,專利號:ZL201110117578.1)。鹽酸莫西沙星片(MXF,0.4 g×3 s,拜覆樂,拜爾醫藥保健有限公司,國藥準字J20150015)。硫酸沙丁胺醇片(STL,2 mg×100 s,金壇,江蘇亞邦愛普森藥業有限公司,國藥準字H32024535)。
1.4 試劑和儀器
大鼠酶聯免疫吸附測定(ELISA)試劑盒和大鼠sIgA(E-EL-R0875c)購於武漢伊萊瑞特生物科技股份有限公司,蘇木素伊紅(HE)染色試劑盒購於北京索萊寶科技有限公司,石蠟塊、二甲苯溶液、無水乙醇和中性樹脂購於國藥集團,兔抗大鼠多克隆抗體CD3(E-AB-40132)購於武漢伊萊瑞特生物科技股份有限公司,兔抗大鼠多克隆抗體CD4(K006374P)購於北京索萊寶科技有限公司,鏈黴親和素-鹼性磷酸酶(SABC-AP)免疫組化染色試劑盒(SA1055)購於武漢博士德生物工程有限公司。WBP無束縛小動物全身體積描記儀和Fine PointeTM series PFT檢測系統購於美國諦思藹貿易有限公司,烘箱購於上海新苗醫療裝置有限公司,BS210S電子天平購於德國賽多利斯集團,LDZ5-2離心機購於美國賽默飛世爾科技有限公司,RM2145自動切片機購於德國徠卡顯微系統貿易有限公司,YT-7F8生物組織攤烤片機和YB-6LF生物組織石蠟包埋機購於湖北省孝感市亞光醫用電子技術有限公司,PM-10AD光學顯微鏡及影象採集系統購於日本奧林巴斯銷售服務有限公司,IVC-Ⅱ動物飼養籠具購於江蘇省蘇州市馮氏實驗動物裝置有限公司。
1.5 實驗方法
大鼠適應性飼養7 d,室溫(25±1)℃,溼度(50%±10%),換氣量(15±5)次/h,氨濃度≤14 mg/m3,噪聲≤60 db。12 h晝夜交替照明,自由飲純水、飼料。採用EXCEL RAND函式法將60只大鼠隨機分為對照組、COPD穩定期(COPD)組、AECOPD組、西藥組、中西醫結合組。每日觀察並記錄大鼠一般情況,包括皮毛色澤,活動度,靈敏度,進食、進水量等。本實驗已透過河南中醫藥大學第一附屬醫院倫理委員會審批(批號:YFYDW2018015)。
1.6 模型製備
1.6.1 預實驗
採用梯度濃度LPS溶液鼻腔內滴注聯合香菸煙霧暴露法制備COPD穩定期-急性加重期模型,熱暴露法模擬痰熱證。80只大鼠隨機分為對照組、LPS 0.5 mg組、LPS 1.0 mg組、LPS 2.0 mg組,每組20只。第0周、第4周、第8周、第12周和模擬急性加重前,檢測肺功能並分析資料;第8周、第12周結束時,分批取材觀察肺組織病理。除對照組、COPD組外,第13周第1天起,半數模型大鼠進行熱暴露並持續9 d,模擬痰熱證。第13周第6天,將熱暴露的大鼠鼻腔內一次性滴注濃度加倍的LPS模擬急性加重期。第13周第5天起,每日檢測所有大鼠肛溫,隔日尾靜脈採血,檢測血常規各指標,血清C反應蛋白(CRP)和血清澱粉樣蛋白A(SAA)表達水平至炎性指標恢復至接近COPD穩定期水平。
綜合肺組織病理、肛溫、CRP和SAA,LPS 1.0 mg組大鼠於第8週末已成功建立COPD穩定期大鼠模型,LPS溶液濃度適宜,大鼠死亡率低。確定COPD穩定期大鼠模型的建立週期為8周,LPS鼻腔內滴注的最佳濃度為1 mg/kg體質量,COPD痰熱證急性加重期的LPS最佳濃度為2 mg/kg體質量,急性加重持續時間為6~8 d。該模型的炎症特點、肺功能、肺形態學具有穩定性,適宜用於後續研究。
1.6.2 實驗模型
COPD穩定期模型:除對照組外,其餘組別給予LPS溶液以1 mg/kg體質量經鼻腔滴入,2次/周,持續8周[13];對照組大鼠滴入等體積0.9%氯化鈉溶液。除對照組外,其餘組別均進行香菸煙霧暴露,採用有機玻璃燻煙箱,體積189 L,煙霧濃度(3 000±500)ppm,30 min/次,2次/d,間隔≥3 h,持續8周;對照組大鼠置於通風良好的室內。經鼻腔滴入LPS溶液當天,不進行香菸煙霧暴露。模型成功標準依據預實驗及文獻[14]。
COPD痰熱證急性加重期模型:除對照組、COPD組外,於造模第9周第1天起,將半數模型大鼠置於烘箱進行熱暴露,溫度(38±1)℃,溼度50%,風速1 m/s,30 min/次,2次/d,間隔≥3 h,持續9 d模擬痰熱證[14]。實驗第9周第6天給予熱暴露的大鼠鼻腔滴入LPS溶液2 mg/kg體質量模擬急性加重期。急性加重當天,不進行熱暴露。
1.7 藥物干預
西藥組、中西醫結合組於造模第9周第7天分別灌胃相應藥物,急性加重期灌胃持續8 d、穩定期灌胃持續14 d[14],對照組、COPD組及AECOPD組全程灌胃0.9%氯化鈉溶液,各組藥物干預計劃見表1。藥物劑量採用等效劑量係數換算公式計算。D大鼠=D人×(HI大鼠/HI人)×(W人/W大鼠)2/3。注:D為劑量,HI為體型係數,W為體質量。各藥物灌胃劑量:通塞顆粒為7.2 g·kg-1·d-1,補肺益腎方為4.42 g·kg-1·d-1,鹽酸莫西沙星片為0.027 g·kg-1·d-1,硫酸沙丁胺醇片為0.41 mg·kg-1·d-1;每週稱量一次大鼠體質量,以調整灌胃用量。
表1 各組藥物干預計劃
Table 1 Intervention plans of five groups of rats
1.8 取材與指標檢測
藥物干預結束後取材,取材前大鼠禁食12 h,自由飲水。採用3%戊巴比妥鈉(2.5 ml/kg)腹腔麻醉,氣管插管,檢測肺功能,隨後腹主動脈採血並取材。
1.8.1 體質量
每週稱量大鼠體質量(g)。
1.8.2 肺功能造模
第0、1、4、8周和急性加重前分別使用WBP無束縛小動物全身體積描記儀檢測潮氣量(TV)、呼氣峰流速(PEF)、50%潮氣量呼氣流量(EF50);取材前使用Fine PointeTM series PFT檢測FVC、FEV0.3,計算FEV0.3/FVC。
1.8.3 肺、腸組織CD3+和CD4+表達水平
取左肺經左主支氣管恆壓灌注10%中性甲醛溶液2 h,然後置於新鮮配製的10%中性甲醛固定液中固定72 h。從肛門向上擷取5 cm腸組織,清除其內容物,0.9%氯化鈉溶液洗2次,置於新鮮配製的10%中性甲醛固定液中固定72 h。分別切取3 mm組織,石蠟包埋,4 μm切片,常規HE染色。採用免疫組化試劑盒檢測CD3+和CD4+表達。
1.8.4 肺、腸組織sIgA表達水平
分別取右肺下葉100 mg組織和100 mg腸組織,用無菌剪剪碎,按1∶9比例加入0.9%氯化鈉溶液,放置於組織破碎機10 min進行充分勻漿,3 000 rpm離心10 min(r=5 cm),收集上清液。ELISA試劑盒檢測sIgA表達水平。
1.8.5 顯微鏡觀察
每張切片取6個視野(200×),採用Image-Pro Plus 6.0影象分析軟體(USA),以棕黃色區域光密度值(IOD)的平均值統計陽性結果。
1.9 統計學方法
採用GraphPad Prism 7.0軟體進行統計並作圖。計量資料以(
±s)表示,多組間比較採用單因素方差分析,方差齊時採用Tukey's法進行多重檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 一般情況
對照組大鼠皮毛光滑,活動度正常,反應靈敏,進食量、進水量如常,糞便呈顆粒狀;其餘組別大鼠皮毛光澤度下降,皮毛色澤偏黃,活動明顯減少、敏捷度下降、出現蜷縮現象,進食量、進水量減少,糞便稀溏不成形。藥物治療後的大鼠進食量、進水量增加,中西醫結合組大鼠的糞便逐漸形成顆粒狀。對照組、COPD組無大鼠死亡,其他組均出現2~3只大鼠死亡,屍檢可見死亡大鼠胸腔出現不同程度的肺淤血、肺體積增大,腹腔出現不同程度的粘連、血性積液。
2.2 體質量
各組大鼠體質量隨周齡增長,其他組別體質量全程低於對照組。第9周急性加重後,AECOPD組持續低增長,見圖1A。干預結束後,五組體質量比較,差異有統計學意義(F=88.74,P<0.05)。COPD組體質量低於對照組,差異有統計學意義(q=16.320,P<0.05);AECOPD組體質量低於COPD組,差異有統計學意義(q=8.925,P<0.05);西藥組、中西醫結合組體質量高於AECOPD組,差異有統計學意義(q西藥組=9.026,q中西醫結合組=10.430,P<0.05);西藥組、中西醫結合組體質量比較,差異無統計學意義(q=1.912,P>0.05),見圖1B。
圖1 各組大鼠體質量變化
Figure 1 Body weight change of rats in each group
2.3 肺功能
第0~8周,對照組大鼠的TV、PEF、EF50隨時間增長,其他組別TV、PEF、EF50全程低於對照組,見圖2A~C。第8周結束時,COPD組、AECOPD組、西藥組、中西醫結合組的TV、PEF、EF50低於對照組,差異有統計學意義(FTV=17.00,FPEF=43.69,FEF50=13.54,P<0.05);COPD組、AECOPD組、西藥組、中西醫結合組TV、PEF、EF50比較,差異無統計學意義(P>0.05),見圖2D~F。
圖2 各組大鼠肺功能變化比較
Figure 2 Changes of lung function of rats in each group
藥物干預結束時,五組大鼠的FEV0.3比較,差異有統計學意義(F=155.70,P<0.05)。COPD組FEV0.3低於對照組,差異有統計學意義(q=20.070,P<0.05);AECOPD組FEV0.3低於COPD組,差異有統計學意義(q=11.310,P<0.05);西藥組、中西醫結合組FEV0.3高於AECOPD組,差異有統計學意義(q西藥組=16.750,q中西醫結合組=24.890,P<0.05);中西醫結合組FEV0.3高於西藥組,差異有統計學意義(q=9.272,P<0.05),見圖2G。
藥物干預結束時五組大鼠FVC比較,差異有統計學意義(F=83.73,P<0.05)。COPD組FVC低於對照組,差異有統計學意義(q=16.190,P<0.05);AECOPD組FVC低於COPD組,差異有統計學意義(q=7.336,P<0.05);西藥組、中西醫結合組FVC高於AECOPD組,差異有統計學意義(q西藥組=13.040,q中西醫結合組=17.640,P<0.05);中西醫結合組FVC高於西藥組,差異有統計學意義(q=5.597,P<0.05),見圖2H。
藥物干預結束時五組大鼠FEV0.3/FVC比較,差異有統計學意義(F=123.00,P<0.05)。COPD組FEV0.3/FVC低於對照組,差異有統計學意義(q=10.560,P<0.05);AECOPD組FEV0.3/FVC低於COPD組,差異有統計學意義(q=16.630,P<0.05);西藥組、中西醫結合組FEV0.3/FVC高於AECOPD組,差異有統計學意義(q西藥組=17.400,q中西醫結合組=25.500,P<0.05);中西醫結合組FEV0.3/FVC高於西藥組,差異有統計學意義(q=9.275,P<0.05),見圖2I。
2.4 肺組織和腸組織sIgA表達水平
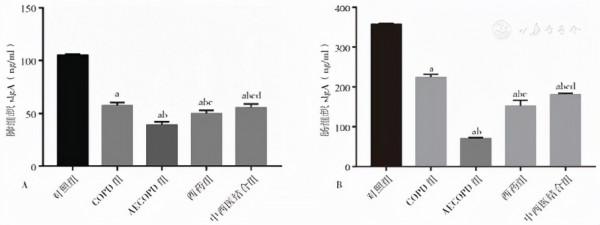
五組大鼠的肺組織sIgA表達水平比較,差異有統計學意義(F=700.20,P<0.05)。COPD組大鼠肺組織sIgA表達水平低於對照組,差異有統計學意義(q=50.030,P<0.05);AECOPD組肺組織sIgA表達水平低於COPD組,差異有統計學意義(q=19.260,P<0.05);西藥組、中西醫結合組肺組織sIgA表達水平高於AECOPD組,差異有統計學意義(q西藥組=10.580,q中西醫結合組=16.000,P<0.05);中西醫結合組肺組織sIgA表達水平高於西藥組,差異有統計學意義(q=5.072,P<0.05),見圖3A。
圖3 各組大鼠sIgA表達水平比較
Figure 3 Expression of sIgA in rats of each group
五組大鼠的腸組織sIgA表達水平比較,差異有統計學意義(F=1 113.00,P<0.05)。COPD組大鼠腸組織sIgA表達水平低於對照組,差異有統計學意義(q=43.460,P<0.05);AECOPD組腸組織sIgA表達水平低於COPD組,差異有統計學意義(q=49.970,P<0.05);西藥組、中西醫結合組腸組織sIgA表達水平高於AECOPD組,差異有統計學意義(q西藥組=26.470,q中西醫結合組=34.530,P<0.05);中西醫結合組腸組織sIgA表達水平高於西藥組,差異有統計學意義(q=9.359,P<0.05),見圖3B。
2.5 肺組織CD3+和CD4+表達水平
五組大鼠的肺組織CD3+表達水平比較,差異有統計學意義(F=96.39,P<0.05)。COPD組大鼠肺組織CD3+表達水平低於對照組,差異有統計學意義(q=15.700,P<0.05);AECOPD組肺組織CD3+表達水平低於COPD組,差異有統計學意義(q=12.980,P<0.05);西藥組、中西醫結合組肺組織CD3+表達水平高於AECOPD組,差異有統計學意義(q西藥組=12.690,q中西醫結合組=16.120,P<0.05);中西醫結合組肺組織CD3+表達水平高於西藥組,差異有統計學意義(q=5.654,P<0.05),見圖4A,圖4C~G。
圖4 各組大鼠肺組織CD3+和CD4+表達水平比較
Figure 4 Expression of CD3+ and CD4+ in lung tissue of rats in each group
五組大鼠的肺組織CD4+表達水平比較,差異有統計學意義(F=418.80,P<0.05)。COPD組大鼠肺組織CD4+表達水平低於對照組,差異有統計學意義(q=34.140,P<0.05);AECOPD組肺組織CD4+表達水平低於COPD組,差異有統計學意義(q=23.150,P<0.05);西藥組、中西醫結合組肺組織CD4+表達水平高於AECOPD組,差異有統計學意義(q西藥組=12.760,q中西醫結合組=16.160,P<0.05);西藥組、中西醫結合組肺組織CD4+表達水平比較,差異無統計學意義(q=3.776,P>0.05),見圖4B,圖4H~L。
2.6 腸組織CD3+和CD4+表達水平
五組大鼠的腸組織CD3+表達水平比較,差異有統計學意義(F=174.10,P<0.05)。COPD組大鼠腸組織CD3+表達水平低於對照組,差異有統計學意義(q=23.510,P<0.05);AECOPD組腸組織CD3+表達水平低於COPD組,差異有統計學意義(q=13.910,P<0.05);西藥組、中西醫結合組腸組織CD3+表達水平高於AECOPD組,差異有統計學意義(q西藥組=8.498,q中西醫結合組=11.460,P<0.05);西藥組、中西醫結合組腸組織CD3+表達水平比較,差異無統計學意義(q=3.288,P>0.05),見圖5A,圖5C~G。
圖5 各組大鼠腸組織CD3+和CD4+表達水平比較
Figure 5 Expression of CD3+ and CD4+ in intestinal tissue of rats in each group
五組大鼠的腸組織CD4+表達水平比較,差異有統計學意義(F=90.66,P<0.05)。COPD組大鼠腸組織CD4+表達水平低於對照組,差異有統計學意義(q=18.800,P<0.05);AECOPD組腸組織CD4+表達水平低於COPD組,差異有統計學意義(q=11.320,P<0.05);西藥組、中西醫結合組腸組織CD4+表達水平高於AECOPD組,差異有統計學意義(q西藥組=10.430,q中西醫結合組=13.240,P<0.05);西藥組、中西醫結合組腸組織CD4+表達水平比較,差異無統計學意義(q=3.348,P>0.05),見圖5B,圖5H~L。
3 討論
本實驗的模型組大鼠皮毛光澤度下降,皮毛色澤偏黃,表現出活動明顯減少、敏捷度下降、蜷縮現象,進食量、進水量減少,體質量增長速度緩慢,糞便稀溏不成形。藥物治療後的大鼠進食量、進水量增加,體質量較AECOPD組大鼠顯著增長,糞便逐漸形成顆粒狀。臨床重度和極重度COPD的常見症狀包括腹脹便溏、形體消瘦、倦怠無力等[15,16],對判斷預後具有重要價值[17]。肌肉量降低的COPD患者,在院內死亡率、住院天數、住院費用方面顯著高於非肌肉量降低的患者[18]。以上研究結果提示,中西醫結合治療COPD痰熱證急性加重-穩定期大鼠,能夠透過提高大鼠的進食、進水量,促進大鼠體質量增長,透過改善糞便狀態,緩解大鼠腹瀉表現,從而改善大鼠的生存質量。
本實驗於第8周結束後,模型組大鼠的TV、PEF、EF50顯著低於對照組;取材前,AECOPD組大鼠的FVC、FEV0.3和FEV0.3/FVC顯著低於西藥組和中西醫結合組,且中西醫結合組療效更顯著。COPD的特點是持續的呼吸道症狀和氣流受限,臨床中的肺功能檢測是對氣流限制最具重複性和客觀性的測量方法[1]。本實驗中,模型大鼠的肺功能相關指標降低與臨床研究肺功能的變化一致,提示中西醫結合治療COPD痰熱證急性加重-穩定期,能夠透過提高肺功能從而改善大鼠的呼吸功能。
本實驗中,AECOPD組大鼠肺組織和腸組織中的sIgA表達水平顯著低於對照組,藥物治療可使肺組織和腸組織中sIgA表達水平升高,中西醫結合治療組的sIgA表達水平升高更顯著。COPD患者氣道表面普遍存在sIgA表達缺損[2],與慢性細菌侵襲、中性粒細胞炎症及COPD氣流阻塞的嚴重程度相關[3,4]。當呼吸道感染時,病原微生物入侵併黏附於上皮,刺激黏膜區域性產生免疫應答,並透過黏膜免疫歸巢遷移的途徑影響傳變到腸道,使肺和腸道的sIgA的合成與分泌減少,黏膜區域性抗感染能力較弱,又增加肺部病變。慢性炎症與免疫機制相互交織,相互促進,形成惡性迴圈[19]。中西醫結合治療COPD痰熱證急性加重-穩定期大鼠,能夠顯著升高大鼠肺組織和腸組織中的sIgA表達水平,從而改善肺組織和腸組織的免疫屏障功能。
本實驗顯示,各模型組大鼠肺、腸組織CD3+和CD4+表達水平顯著低於對照組,西藥組、中西醫結合組大鼠肺組織和腸組織的CD3+和CD4+表達水平顯著高於AECOPD組,中西醫結合組肺組織CD3+表達水平升高更顯著。COPD患者肺間質及實質等組織活檢[7]發現了大量T淋巴細胞和巨噬細胞聚集現象,主要炎症表現為CD8+細胞數量增加,CD3+和CD4+細胞數量基本不變或稍降,CD4+/CD8+下降,導致免疫失衡[8]。文獻報道的COPD患者外周血和支氣管肺泡灌洗液中T淋巴細胞亞群異常,氣道中性粒細胞、巨噬細胞和CD8+T淋巴細胞增多,即使停止吸菸後,T淋巴細胞介導的異常肺內炎症仍持續存在,是COPD發生和發展的關鍵因素[9,10]。本研究結果與臨床研究表現一致,提示中西醫結合治療COPD痰熱證急性加重-穩定期,可能透過改善大鼠T淋巴細胞的表達,提高免疫水平、延緩COPD疾病程序。
綜上所述,本研究採用中西醫結合治療COPD痰熱證急性加重-穩定期大鼠,上調了肺組織和腸組織sIgA、CD3+和CD4+的表達水平,表明了通塞顆粒/補肺益腎方聯合西藥治療COPD急性加重-穩定期大鼠可能透過提高大鼠肺組織和腸組織sIgA、CD3+和CD4+的表達水平,修復肺組織和腸組織的免疫屏障功能,提高大鼠免疫力。由於缺乏中西醫結合治療對COPD痰熱證急性加重-穩定期肺、腸組織sIgA、CD3+和CD4+表達水平影響的相關證據,本研究填補了該研究領域的空白,為中醫藥防治COPD的深入研究提供參考依據。
利益衝突
本文無利益衝突。
參考文獻 略