支原體核酸法是透過檢測支原體的特異核酸序列,以確定細胞上清或生物製品中是否存在支原體汙染的一種方法。由於它具有檢測時間短(只需3-4h)、操作便捷等特點,越來越受到生物製品企業的青睞。
支原體核酸法包括PCR和qPCR,可作為藥典規定的培養法或DNA染色法的替代方法,或與以上方法相互補充。事實上,早在2011年,就有動物疫苗廠家在2011年第5期的《廣東農業科學》上,報道了用德國Minerva Biolabs(簡稱MB)公司的支原體PCR試劑盒,用於檢測疫苗中是否存在支原體的汙染,它可與培養法互為補充,共同用於生產,為生產提供可靠的資料支援。
但支原體核酸法在用於放行檢測之前,需先進行方法驗證。歐洲藥典和日本藥典均規定了核酸法的靈敏度、特異性和耐用性需要達到的要求。
例如,在靈敏度方面(又稱最低檢測限),要求核酸法替代培養法,則靈敏度需達到10CFU/ml;核酸法替代DNA染色法,則靈敏度需達到100CFU/ml。
在特異性方面,歐洲藥典和日本藥典要求,核酸法要識別指定的常見9種支原體,而不識別與支原體有近緣關係的菌屬,如丙酮丁醇梭菌、嗜酸乳桿菌和肺炎鏈球菌,也不識別其他細菌和哺乳動物DNA。
在耐用性方面,歐洲藥典要求檢測結果不受方法引數的小的偏差的影響,如濃度的變化(MgCl2、引物、dNTP)、提取步驟的細微差別等。實際上這是強調結果的可靠性和穩定性,不受人為操作誤差的影響。這可透過3輪不同時間段內的檢測來實現,每輪進行8次重複檢測,最後觀察結果有什麼變化。
在進行方法驗證時,參比標準品是必不可少的。世界著名微生物防控專家德國MB公司提供有一系列的支原體標準品和支原體DNA標準品,用於支原體核酸法的方法學驗證。
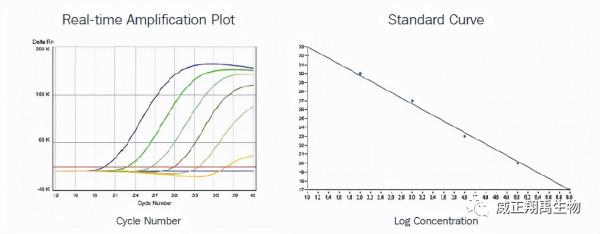
肺炎支原體DNA的定量。
模板DNA的範圍為2X105-2個複製數基因組
值得指出的是,歐洲藥典和日本藥典均要求先進行支原體DNA抽提,再進行核酸法檢測。因此,方法驗證實際上包括了核酸法的這兩部分。
對於生物製品、細胞治療產品的生產企業,在選用已經過廠家全面驗證的支原體檢測試劑盒之外,還需自己按照待測樣本型別進行方法的適用性驗證。因為試劑盒的驗證並不能代替包括操作過程在內的方法的適用性,操作、樣本基質和儀器同樣會對核酸法的技術指標產生不可忽視的影響。