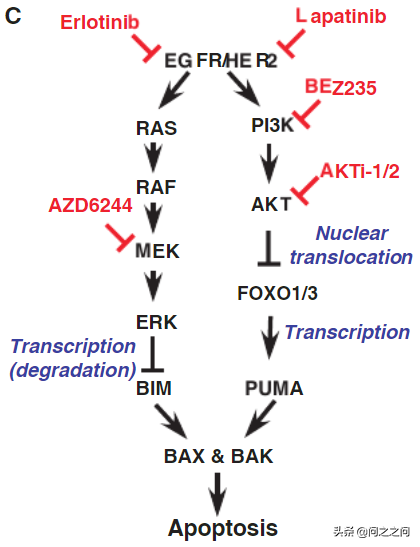
EGFR抑制劑廣泛用於臨床EGFR突變肺癌患者的治療,但最終不可避免地出現獲得性耐藥限制了EGFR抑制劑的療效。在耐藥機制中,一代和二代 EGFR TKIs處理後,EGFR T790M “二次突變”佔獲得性耐藥的~50% -60% 。為了克服這一主要耐藥機制,已經開發出了三代 EGFR 抑制劑,接連獲批用於臨床,包括osimertinib(FDA,2015)、阿美替尼(2020,中國)和伏美替尼(2021,中國)。osimertinib不僅對T790M獲得性耐藥有效,而且作為一線治療優於早期 EGFR TKIs。不幸的是,獲得性耐藥不可避免地發生而且耐藥機制具有異質性,EGFR“二次突變”(C797X,L718X,G724X 等)只在一部分患者中發現(10%-26%)。很明顯,僅僅針對 EGFR 突變不太可能治癒 EGFR突變的非小細胞肺癌患者。誘導腫瘤細胞凋亡是腫瘤靶向治療成功的關鍵。BCL-2家族蛋白是TKI誘導細胞凋亡的關鍵調節因子。BAX和BAK是線粒體外膜透化(MOMP)的主要效應分子,而BCL-2/BCL-XL/MCL-1對MOMP有抑制作用。BH3s透過直接啟用 BAX/BAK 或者使BCL-2/BCL-XL/MCL-1失活來傳遞上游的凋亡訊號來啟動細胞凋亡。在凋亡訊號中,啟用因子 BH3s (BID,BIM,PUMA和NOXA)直接啟用 BAX/BAK 誘導BAX/BAK 同源寡聚化導致MOMP的發生。作者團隊和其他研究人員先前已經確定BIM 和PUMA 是TKI在體內外殺傷EGFR突變NSCLC的關鍵凋亡效應分子。具體來說,抑制MEK-ERK訊號會誘導 BIM,而抑制PI3K-AKT訊號會觸發 FOXO1/3核轉位,反式啟用 PUMA。
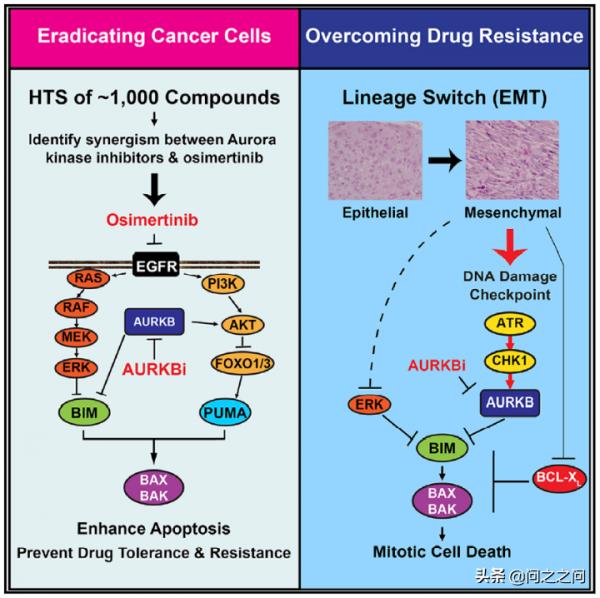
通常認為,對EGFR TKIs的獲得性耐藥是透過選擇已有的耐藥克隆以及“drug-tolerant persisters (DTPs)”(原本致命藥物產生暫時耐受能力的癌細胞亞群)的進化而發生的。隨著時間的推移,DTPs可以透過突變或非突變機制獲得耐藥性。基於這一認識,研究人員假設透過聯用增強細胞凋亡的藥物可以有效消除癌細胞並減緩耐藥的出現。最近,美國紀念斯隆凱特琳癌症研究中心Emily H.Cheng團隊透過對化合物庫高通量篩選發現,Aurora B激酶抑制劑是osimertinib誘導細胞凋亡的強效增強劑,靶向Aurora B激酶能夠預防和克服肺癌對EGFR抑制劑的耐藥,相關論文於2021年8月12日以“Targeting AuroraB kinase prevents and overcomes resistance to EGFR inhibitors in lung cancer byenhancing BIM- and PUMA-mediated apoptosis”為題線上發表在《Cancer Cell》雜誌上。

Cancer Cell. 2021;39(9):1245-1261.e6.
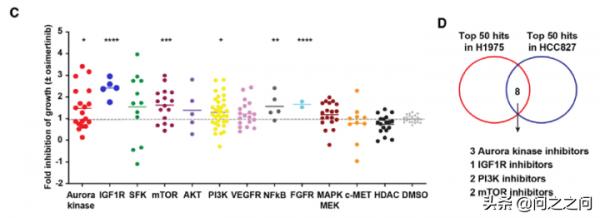
從機制上講,抑制Aurora B減少BIM蛋白 Ser87磷酸化進而穩定BIM蛋白,並透過 FOXO1/3反式啟用 PUMA。重要的是,上皮間質轉變(EMT)引起的osimertinib 耐藥會啟用 ATR-CHK1-Aurora B訊號級聯反應,使用相應激酶抑制劑可以啟用BIM介導的有絲分裂災難(mitotic catastrophe)導致細胞死亡。也就是說,EGFR抑制劑和Aurora B抑制劑聯用不僅可以有效消除癌細胞,還能克服EMT介導的耐藥。該研究首先確定能增強osimertinib在EGFR突變NSCLC中促凋亡作用的聯合用藥策略,透過對一個包含~1000個化合物的定製化合物庫進行高通量篩選,在H1975和HCC827細胞上檢測發現3種Aurora激酶抑制劑、1種IGF1R 抑制劑、2種PI3K 抑制劑以及2種mTOR 抑制劑可以協同抑制細胞增殖。進一步在PC9和PDC細胞ECLC26(L858R)上驗證研究證實Aurora激酶抑制劑是osi誘導不同EGFR突變的NSCLC細胞株凋亡的強效促進劑。
Cancer Cell. 2021;39(9):1245-1261.e6.
Western檢測發現,Aurora激酶抑制劑PF03814735(PF)與osi聯用後,BIM和PUMA蛋白在蛋白水平顯著上調,伴隨著AKT和FOXO1/3磷酸化抑制。qRT-PCR檢測發現,PF介導的PUMA的表達增加主要發生在轉錄水平,而BIM mRNA沒有明顯變化。這些資料表明,PF和osi協同抑制AKT,從而減少FOXO1/3磷酸化,導致FOXO1/3介導的 PUMA 誘導表達。而PF03814735是Aurora激酶抑制劑,對Aurora A 和Aurora B激酶沒有選擇性。研究人員利用siRNA選擇性敲除AURKA或AURKB基因後發現,敲低AURKB基因大大增強了osi誘導的細胞凋亡,並且重現了PF誘導的BIM和PUMA上調,而敲低AURKA基因影響甚微。為了進一步探討 BIM/PUMA 與臨床結果之間的相關性,研究人員評估了TCGA資料中EGFR突變的LUAD患者資料發現,腫瘤組織中PUMA mRNA 的表達顯著增高的患者預後較好,而其BIM mRNA 的表達沒有顯著差異。值得注意的是,預後良好的腫瘤患者的 BIM蛋白水平顯著高於預後不良患者,提示EGFR訊號對BIM蛋白穩定性存在調控作用。與這些發現一致的是,BIM蛋白或PUMA mRNA 表達低的患者,其總體生存期明顯縮短(8.0 vs. 41.1個月)。
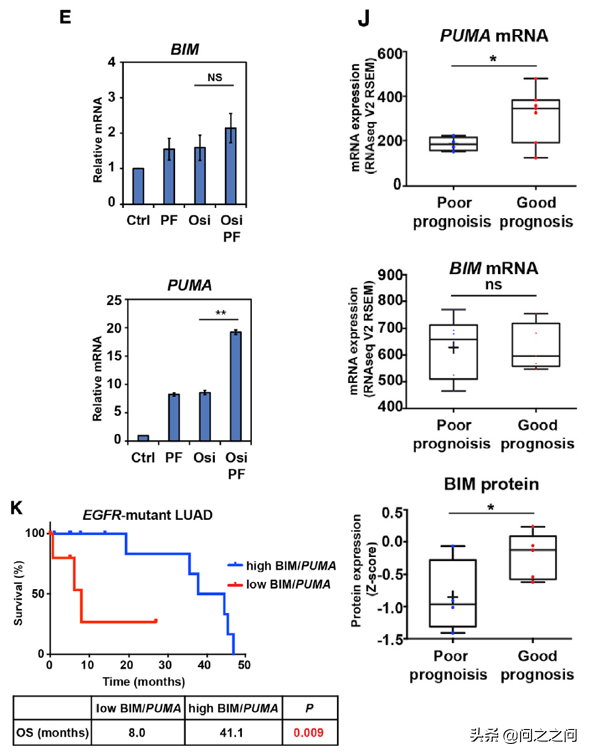
Cancer Cell. 2021;39(9):1245-1261.e6.
由於PF和siRNA介導的BIM誘導主要在蛋白質水平,研究人員進一步研究發現PF 和osi聯用影響了BIM蛋白穩定性。已有文獻報道ERK會影響BIM磷酸化進而影響BIM蛋白穩定性,但PF單用對ERK磷酸化影響較小。於是,研究人員猜測Aurora B可能直接磷酸化BIM引起其磷酸化依賴的泛素化降解。利用SCANCITE 4.0軟體分析和實驗驗證發現,生物學和化學手段抑制AURKB會降低BIM S87磷酸化,導致BIM穩定。
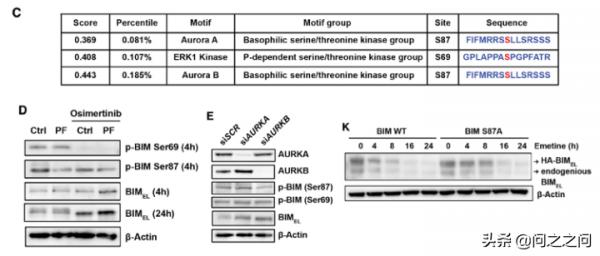
Cancer Cell. 2021;39(9):1245-1261.e6.
到此,研究人員證明了EGFR和AURKB聯合抑制可以有效消除TKI-naïve腫瘤細胞,緊接著提出疑問,這種聯合策略對osi耐藥細胞是否同樣有效。透過構建osi耐藥細胞株H1975R和ECLC26R,RNA-seqGESA分析發現EMT基因上調是主要原因(蛋白水平E-cadherin表達減少、vimentin表達增加)。有趣的是,H1975R和ECLC26R對Aurora激酶抑制劑PF和MLN8054高度敏感。從機制上分析,PF單用可以誘導BIM/PUMA上調,且輕微抑制AKT磷酸化;而osi不能誘導H1975R和ECLC26R細胞凋亡,既沒有減少ERK/AKT磷酸化,也沒有誘導BIM/PUMA。為了明確EMT和osi耐藥以及Aurora激酶抑制劑敏感性之間的因果關係,研究人員試圖透過干擾EMT關鍵調節因子來誘導H1975發生EMT。同時敲除FOXA1/2和過表達ZEB1 (H1975FZ)重現了EMT特徵 (E-cadherin減少、vimentin增加),H1975FZ對osi耐藥且對Aurora激酶抑制劑敏感,這些資料表明osi耐藥細胞的EMT特徵與其對Aurora激酶抑制劑的敏感性是有關的。進一步研究發現,多種Aurora激酶抑制劑以及siRNA敲低AURKB可以誘導osi耐藥的EMT細胞凋亡,而AURKA選擇性抑制劑MK5108以及敲低AURKA不能誘導凋亡。為了明確osi耐藥的EMT細胞對AURKB抑制劑高度敏感的分子機制,研究人員分析RNA-seq資料發現,在H1975R和ECLC26R中ATM和ATR上調,並透過免疫印跡驗證。ATR透過其下游效應器CHK1調節AURKB進而控制細胞分裂是已知的。相應地,在H1975R和ECLC26R細胞中發現CHK1S345磷酸化增加,而且AURKB自磷酸化顯著增加,說明在osi耐藥EMT細胞中AURKB是啟用的。這些結果表明ATR-CHK1-AURKB訊號在osi耐藥EMT細胞中被啟用,且在H1975FZ細胞中重現了這一結果。
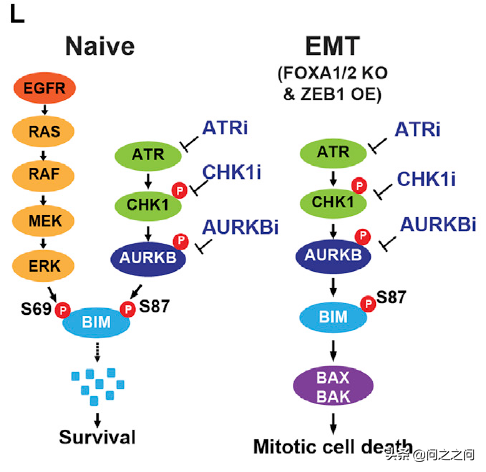
Cancer Cell. 2021;39(9):1245-1261.e6.
最後,研究人員在小鼠異種移植模型中證實osi和PF聯合比osi單用體內療效更好,無論是親本H1975,還是透過EMT對osi獲得性耐藥的H1975R模型。在兩種PDX模型上,osi和PF聯合同樣有效地抑制腫瘤生長。總之,這些資料表明,無論是否有EMT,osi和PF聯用對於treatment-naïve或者osi耐藥的EGFR突變NSCLC都是一種有效的治療策略。
Cancer Cell. 2021;39(9):1245-1261.e6.
值得注意的是,AURKA也被報道介導EGFR三代抑制劑耐藥(Nat Med 25, 111–118 (2019)),而在本文研究中AURKB啟用相較AURKA更明顯。同時也有其他研究表明AURKB啟用是一代和三代TKIs獲得性耐藥機制,並伴有磷酸組蛋白 H3(pH3)水平增加(Nat Commun 10, 1812 (2019))。
參考文獻:
Tanaka K, Yu HA, Yang S, et al. Targeting Aurora B kinase prevents and overcomes resistance to EGFR inhibitors in lung cancer by enhancing BIM- and PUMA-mediated apoptosis. Cancer Cell. 2021;39(9):1245-1261.e6.
Shah KN, Bhatt R, Rotow J, et al. Aurora kinase A drives the evolution of resistance to third-generation EGFR inhibitors in lung cancer. Nat Med. 2019;25(1):111-118.
Bertran-Alamillo J, Cattan V, Schoumacher M, et al. AURKB as a target in non-small cell lung cancer with acquired resistance to anti-EGFR therapy. Nat Commun. 2019;10(1):1812.