體內生化定量
熒光壽命是熒光團在發射熒光光子返回基態之前保持其激發態的平均時間長度。這取決於熒光團的分子組成和奈米環境。
FLIM將壽命測量與成像相結合:對每個影象畫素以測得的熒光壽命進行顏色編碼,產生額外的影象反差。因此,FLIM可以提供關於熒光分子空間分佈的資訊和有關其生化狀態或奈米環境的資訊。 FLIM的典型應用是FLIM-FRET。FRET是研究分子相互作用的成熟技術。它能用來研究蛋白質結合並在埃的尺度上估算分子間的距離。
FRET—原理
熒光共振能量轉移(FRET)描述了儲存在激發的熒光分子(供體)中的能量向其附近的非激發的熒光分子(受體)的非輻射轉移。FRET的發生必須滿足三個條件:
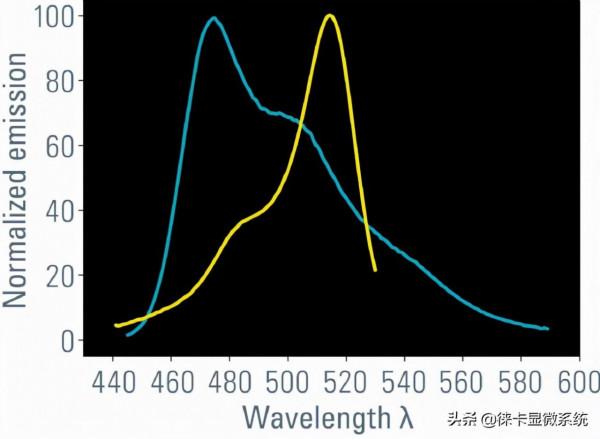
供體發射光譜與受體激發光譜的重疊(圖1)
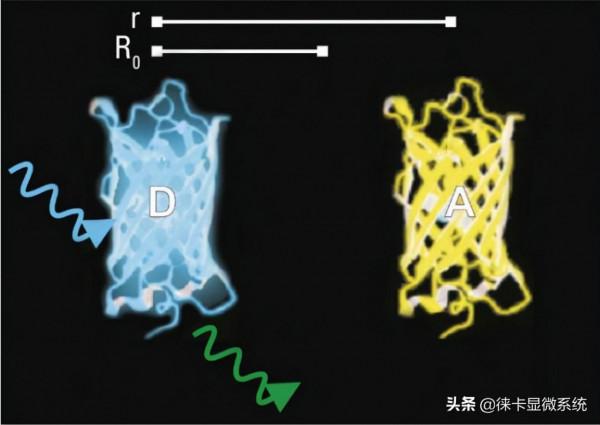
在奈米(10–9 m)級上分子必須非常接近(圖2–4)
分子必須具有適當的相對方位
圖1:供體的發射光譜(此處為ECFP,藍線)必須與受體的激發光譜(此處為EYFP,黃線)重疊。這一要求意味著FRET對中的兩個分子都具有相容的能級。
圖3:在遠大於閾值R0(也稱為福斯特半徑)的距離r處,無能量轉移。
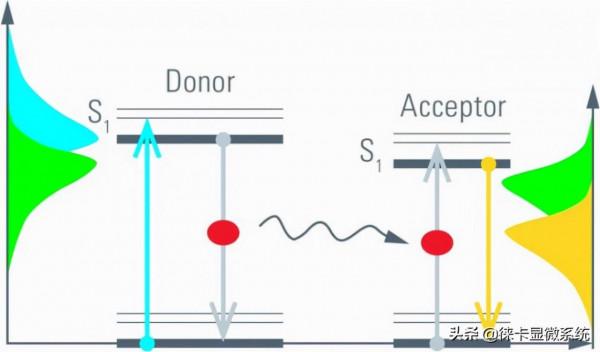
圖4:如果分子緊密接觸,則來自激發光子(藍色箭頭)的能量以非輻射方式轉移到受體。後者又發射光子(黃色箭頭)。該過程(E)的效率與r–6密切相關。
影響
由於與r-6密切相關(圖4),FRET發生在與生化反應高度相關的空間尺度上,例如蛋白質-蛋白質或蛋白質-DNA相互作用。FRET可以透過靈敏的熒光讀數來探測分子間的相互作用。這能讓研究人員在體外和體內研究分子相互作用。透過合適的熒游標記將兩個相關的相互作用方連線起來,可以分析雙分子相互作用。FRET還允許構建生物探針,透過強烈的構象變化導致的分子內FRET來報告第二信使的濃度或離子強度。
FRET無疑已發展成為細胞生物學、生物物理學和生物醫學成像中廣泛使用的工具。
方法論
有很多技術可以在顯微鏡環境中檢測FRET。常見的的是基於供體(受體光漂白,FRET AB)或受體(敏化發射,FRET SE)熒光強度的技術。
使用標準共聚焦顯微鏡可以輕鬆應用基於強度的FRET。但它也存在缺點。FRET AB不能應用於時間序列實驗,並且容易受到供體分子的可逆光漂白或光轉換的影響。另一方面,FRET SE受到所有FRET對固有光譜串擾的影響,需要仔細的校準測量以及對所得影象的線性拆分。本文介紹了一種基於熒光壽命顯微成像 (FLIM) 的FRET測量方法。
熒光壽命
熒光過程通常被理解為分子中從電子基態(S0)到其激發態(S1)的能量躍遷。(圖5,左)。這種躍遷可由具有適當能量(即頻率或波長)的入射光引起。吸收的能量由熒光分子儲存一小段時間,然後才能作為熒光發射。分子處於激發態的時間稱為熒光壽命。對於許多有機染料和熒光蛋白,熒光壽命通常為幾納秒(10–9 s)左右。
熒光壽命和FRET
從激發態弛豫的另一種過程是FRET。透過FRET激發,能量以非輻射方式轉移到受體分子。然後受體分子以熒光方式弛豫(圖5,右)。由於供體發熒光和能量轉移是一個相互競爭的過程,因此在存在FRET的情況下,激發態的消耗速率會增加。有人可能會說,供體分子處於激發態的時間越長,發生FRET的可能性就越大。只能觀察到來自供體分子且透過熒光弛豫的光子。轉移到受體分子的能量由於受體熒光的波長較長而不會被檢測到。 因此,FRET縮短了供體熒光壽命(圖6)。
圖5:FRET對中的能量躍遷。與供體分子中的躍遷能匹配的光被吸收(藍色箭頭)。激發的供體可以透過熒光(灰色箭頭,左)或透過共振能量轉移到受體分子(黑色箭頭)而弛豫。
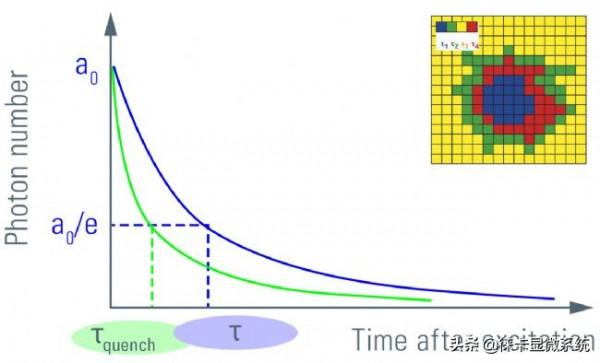
圖6:對激發後一段時間內檢測到的熒光光子數作圖。激發脈衝後發射光子的初始數量a0呈指數衰減。熒光衰減到a0/e (~ 37%)所需的時間為熒光壽命。由於存在FRET (τ-quench),壽命τ變為更短的時間。壽命衰減的另一個讀數是振幅a0。測量掃描系統中每個位置的壽命會產生壽命的空間圖(見插圖)。
熒光壽命成像 (FLIM)
Leica SP8 FALCON使用脈衝鐳射和單光子計數檢測器在時域中測量熒光壽命。透過建立檢測到的熒光事件的直方圖來確定壽命。可顯示單指數或多指數熒光衰減。數值曲線擬合表示熒光壽命和振幅(即檢測到的光子數)。
由於FRET減少了供體壽命,因此如果無FRET的供體壽命已知,就可以量化FRET發生的程度。該供體壽命τ作為分析FRET樣品的絕對參考。因此,FLIM-FRET為內部參照—這一特點減少了基於強度測量FRET時的很多缺點。由於其熒光壽命是染料的固有特性,因此對其他不利影響(如光漂白、影象明暗處理、不同濃度或表達水平)具有廣泛的不變性。
使用基於強度的FRET測量的主要限制是所有可觀察的供體分子都經歷FRET的基本假設。通常情況並非如此。供體分子這種變化的“非結合”組分給測量的FRET效率帶來了相當大的不確定性,使得無法在實驗之間進行比較。FLIM-FRET克服了這一缺點。
使用活細胞記錄FLIM影象
如前所述,FRET效率根據發生FRET供體的壽命τquench與未發生FRET的壽命τ的比率計算得出:
為此,τ必須從僅包含供體的樣品進行的測量來獲得。必須排除來自受體的任何發射光。外部檢測器通常使用帶通濾色片。而內部探測器可調節檢測範圍為只記錄供體發射光。測量僅供體樣品和FRET樣品時必須使用相同的設定。
活細胞中的CFP-YFP FRET
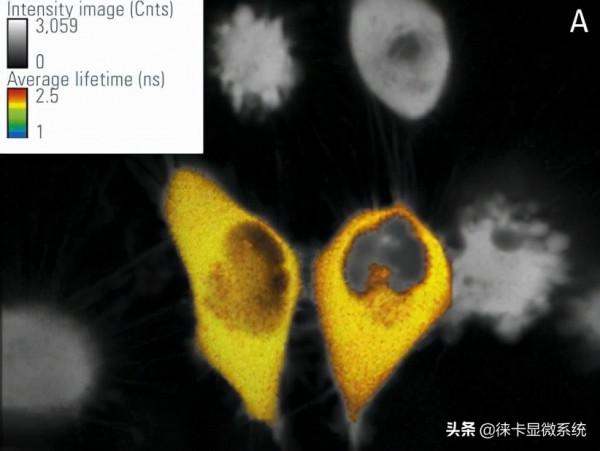
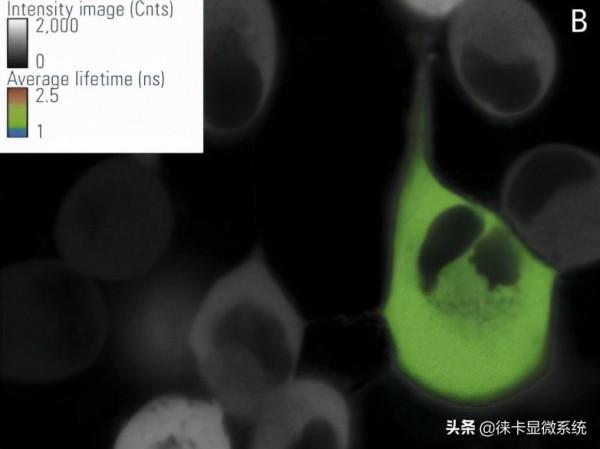
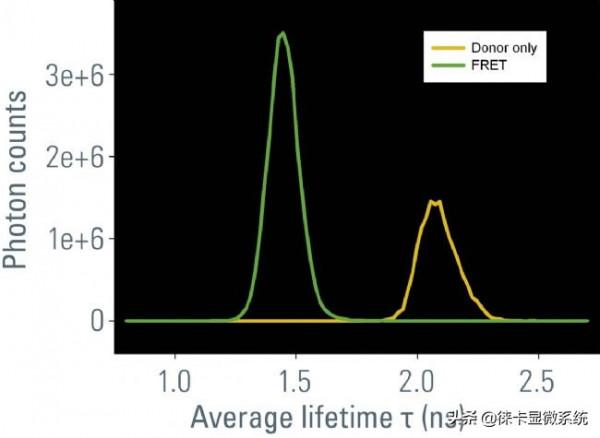
在該工作中,我們使用由CFP-YFP融合蛋白組成的FRET構建體瞬時轉染的培養RBKB78細胞(圖7)。兩個熒光蛋白由兩個氨基酸的短連線物連線[1]。這種供體-受體融合也可以作為真實場景中FRET的良好陽性對照。“僅供體”樣品由僅用CFP轉染的相同細胞組成(圖7A)。僅供體和FRET樣品(圖7B)的平均壽命可在快速FLIM模式下計算出近似值。壽命分佈直方圖表明供體的平均壽命τ為2.1 ns(圖8)。FRET結構的供體壽命為1.4 ns。於是測得FRET效率E = 1 – (1.4/2.1) = 33%。
頂行:圖7:僅用CFP供體(A)和CFP-YFP融合(B)轉染的RBKB78細胞。使用光譜型FLIM檢測器將檢測範圍設定在445-495 nm之間。對彩色區域進行分析,顏色代表強度調製的熒光壽命。由德國維爾茨堡大學Gregory Harms教授提供。感謝Benedikt Krämer博士(Picoquant,柏林)、Jan-Hendrik Spille和Wiebke Buck對本實驗的支援。
底行:圖8:按平均壽命統計樣品中僅供體(黃色)和發生FRET(綠色)的訊號的熒光壽命分佈。在FRET樣品中,壽命明顯變短0.7 ns。
FRET與無FRET的比率
眾所周知,CFP本身至少有兩個壽命組分[2,3]。此外,我們不知道研究中的所有分子是否都經歷FRET。為了公正處理這種複雜性,人們需要了解平均壽命以外的資訊。我們可以進行雙組分擬合,以此得到兩個壽命和兩個振幅。後者能使我們估算一個壽命與另一個壽命的相對比例。尤其是使用振幅可以估算表現出FRET的組分(結合組分)和不表現出FRET的組分(遊離組分)的相對比例。含有較少第二個組分的熒光蛋白,例如EGFP或Sapphire,是此類分析的理想選擇。