點選上方藍字關注我們
WB 的用途及優點
除作為鑑定複合物(組織、細胞樣品)中感興趣的蛋白質的必要分析技術之外,WB 資料也可使用半定量方法以確定和比較各種細胞和組織中特定蛋白質的表達。
雖然 WB 技術也可用於絕對定量,但這需要純化的靶蛋白的線性標準曲線,且勻漿液中的目標蛋白質必須在標準曲線的範圍內,因此蛋白質印跡很少用於絕對定量。
在大多數生命科學實驗室中,使用 WB 半定量蛋白質非常普遍。WB 涉及透過凝膠電泳分離天然或變性蛋白質,將這些分離的蛋白質轉移至蛋白質結合膜,隨後透過靶蛋白特異性抗體檢測靶蛋白質。經典的 WB 過程如下:
電泳→轉膜→封閉→一抗孵育→二抗孵育→洗膜→顯影→分析
WB 的優點包括能夠檢測樣品中皮克級蛋白質,使該技術可用於多種用途,包括作為有效的早期診斷工具。
WB 的敏感性和特異性主要歸功於兩個方面因素:
1、 透過凝膠電泳分離大小、電荷和構象不同的蛋白質。對於十二烷基硫酸鈉(SDS)— 聚丙烯醯胺凝膠電泳(PAGE),蛋白質變性並透過與 SDS 結合而帶負電荷。
然後基於大小分離。透過蛋白質印跡鑑定的蛋白質的分子量可以透過蛋白 Marker 來確定。
2、 抗原抗體特異性結合。特異性抗體可在含有 > 100,000 種不同蛋白質的複雜混合物中檢測出靶蛋白。
當使用二維(2D)電泳代替一維(1D)電泳時,可以鑑定具有相似分子量的同種型和翻譯後修飾的靶蛋白。
細節1:究竟什麼是WB實驗的陽性對照?為什麼要設立陽性對照?
陽性對照(Positive Control)是已知或公認有目的蛋白表達的樣本。當對一個靶標並無檢測經驗時,在實驗初期,強烈建議增加陽性對照幫助排查一系列問題。內參蛋白(如β-actin, GAPDH等),並非靶標蛋白的陽性對照。
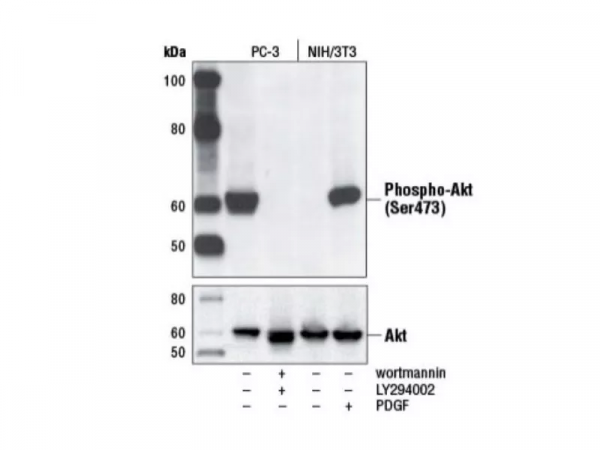
如圖1所示,利用使用抑制劑或生長因子處理,製備針對p-AKT(Ser473)的陰性或陽性對照。
細節2:裂解樣本用什麼裂解液?
對於全細胞裂解,建議使用Cell Lysis Buffer (#9803)、RIPA緩衝液 (#9806)或SDS上樣緩衝液 (#7722)。Cell Lysis Buffer由於不含會使蛋白變性的強力去垢劑,僅含1% Triton,使其可在多種實驗中被使用(如WB、IP)。RIPA緩衝液含有NP40和脫氧膽酸鈉,變效能力更強,可以裂解細胞或者組織。SDS上樣緩衝液也可以裂解細胞樣本,但會干擾後續的BCA測定。
細節3:裂解後直接煮樣變性嗎?
不。樣本裂解後,建議進行超聲。超聲可以破壞膜結構,斷裂DNA,降低樣本的粘稠度,讓樣本更加均質化,增加蛋白的溶解,提高實驗結果的一致性。對於核蛋白或者膜相關蛋白,超聲步驟尤為重要(圖3)。
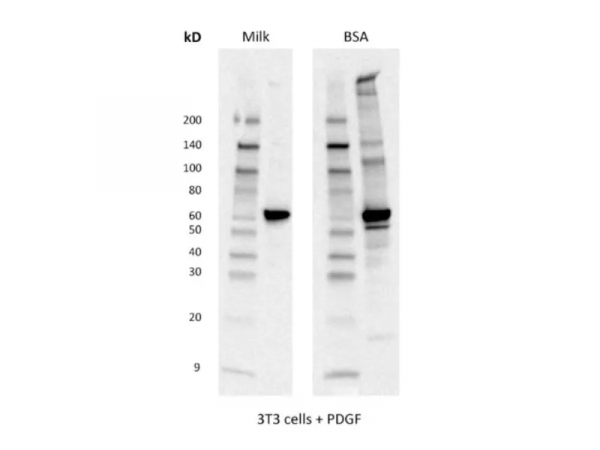
4)封閉:BSA還是奶粉?聽說磷酸化蛋白要用BSA封閉?
BSA僅含有一種蛋白質,奶粉則含有多種,故其封閉效果優於BSA(圖4)。對於磷酸化蛋白的封閉,二十餘年的磷酸化蛋白抗體研發經驗告訴我們,新鮮配置的牛奶不會對磷酸化訊號產生任何影響,但隨著牛奶儲存時間的延長(即便在4℃),就可能使磷酸化訊號下降。
WB實驗的流程為兩天,上述四個細節僅是其中一小部分,從實驗設計到最後顯影,其實每一小步都包含大道理。