近日,西比曼生物科技宣佈,FDA授予公司細胞治療產品C-CAR039再生醫學先進療法(RMAT)資格和快速通道(FT)資格,用於治療復發或難治性及瀰漫性大B細胞淋巴瘤(r/r DLBCL)。C-CAR039是一種新型第二代4-1BB雙靶點CAR-T,同時作用於CD19和CD20雙靶點,可以在體內和體外有效清除CD19/CD20單陽性或雙陽性腫瘤細胞。
開啟百度APP看高畫質圖片
目前,FDA已批准5款CAR-T細胞療法上市,NMPA批准2款CAR-T細胞療法上市,上市的CAR-T細胞療法均為單靶點CAR-T細胞療法,尚無雙靶點CAR-T細胞療法獲批上市。但考慮到惡性腫瘤複雜的發病機制,針對單一靶點的CAR-T療法可能無法表現出足夠的治療效果,因此研究人員將目光投向了雙靶點CAR-T細胞療法,這與雙抗的誕生有異曲同工之妙。
1
雙靶點CAR-T概述
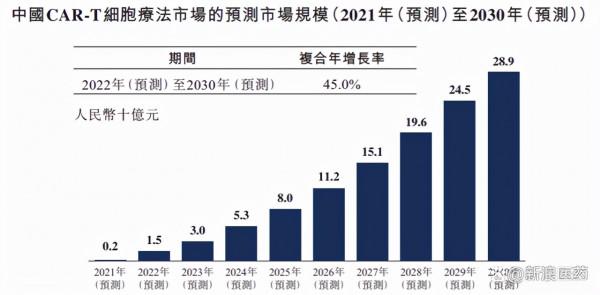
在國內癌症患者人數持續增長及支付能力不斷提升的背景下,CAR-T細胞療法憑藉其療效優勢被寄予厚望。從機制的角度,CAR-T產品可以以非MHC限制性的方式識別和殺傷腫瘤細胞,靶向性克服免疫逃逸,因此療效有望超越單抗、雙抗、ADC等產品。據弗若斯特沙利文的預測,2022年中國CAR-T細胞療法市場規模有望達到15億元,到2024年有望增長至53億元,到2030年有望實現239億元的市場規模。
圖:中國CAR-T細胞療法市場的預測市場規模 (十億元)
資料來源:弗若斯特沙利文
儘管單靶點CAR-T產品目前在臨床研究中已顯示出良好的療效,但仍有部分患者在接受CAR-T治療後出現疾病進展或復發,有觀點認為疾病的進展或復發的根本原因在於腫瘤細胞表面特定靶點的丟失或表達的減少。因此透過增加一個結合位點,即同時靶向兩個抗原或抗原的不同表位,雙特異性靶點CAR-T有望提升治療的特異性,更加準確地靶向腫瘤細胞並降低脫靶毒性,從而增強腫瘤細胞的殺傷毒性。
2
雙靶點CAR-T佈局
儘管目前全球尚無雙靶點CAR-T獲批上市,但一批企業對雙靶點CAR-T產品寄予厚望。從靶點的選擇上,CD19×CD22 CAR-T是關注度最高的靶點組合,馴鹿醫療、恆潤達生、森朗生物等企業深耕於此,傳奇生物還佈局了獨有的CD19×CD20×CD22三靶點產品;此外,CD19×BCMA CAR-T產品的研發浪潮亦此起彼伏,吸引了一批國內製藥企業佈局。
(1)CD19×CD22 CAR-T:CD19和CD22均特異性表達於多種B細胞腫瘤表面。目前,全球已有多款CD19 CAR-T獲批上市,但有研究發現部分B細胞腫瘤患者接受了CD19 CAR-T治療後仍會出現疾病的進展和復發。原因在於一些原本表達CD19的腫瘤細胞面對CAR-T細胞治療的威脅時,會轉而表達CD22蛋白,以逃避攻擊。因此,採用CD19和CD22複合靶向CAR-T療法,理論上可降低治療後單個靶點的丟失導致腫瘤治療逃逸的風險,進一步降低疾病復發。
馴鹿醫療的CT120為一款靶向CD19和CD22的全人源自體嵌合抗原受體T細胞注射液,該產品的CAR分子胞外結構域包含能特異性結合CD19和CD22的兩段全人源scFv序列,透過識別表達CD19和/或CD22的腫瘤細胞以減少靶抗原丟失導致的腫瘤細胞逃逸。2021年11月,FDA授予CT120孤兒藥資格認定,未來CT120將享有的優惠政策包括FDA對臨床研究的支援、註冊費用的減免,以及FDA批准上市後在美國的七年市場獨佔權。
恆潤達生的抗人CD19-CD22 T細胞注射液是一種針對CD19-CD22靶點的基因工程修飾的自體CAR-T細胞製品,其作用機理是經逆轉錄病毒載體體外基因工程修飾,使得T細胞攜帶CAR元件。這一元件使得T細胞表面表達抗CD19和CD22抗體,能特異性地識別B細胞表面的CD19和CD22分子,與之結合進而啟用活化訊號,由此對錶達CD19/CD22的細胞發揮靶向殺傷作用。2021年1月,抗人CD19-CD22 T細胞注射液獲得臨床試驗模式許可,用於治療B-ALL。
(2)CD19×BCMA CAR-T:BCMA是多發性骨髓瘤的有效治療靶標,目前,靶向BCMA的ADC藥物Blenrep和BCMA CAR-T Abecma已獲批上市。有研究發現,儘管CD19在多發性骨髓瘤細胞表面呈現低表達,但在多發性骨髓瘤祖細胞中,CD19呈現高表達。因此,靶向CD19和BCMA有望增強對多發性骨髓瘤細胞的清除。
亙喜生物的GC012F是基於FasTCAR平臺開發的靶向CD19和BCMA的自體CAR-T細胞療法,適應症為多發性骨髓瘤,目前處於臨床Ⅰ期。在2021 ASCO上,亙喜生物公佈了GC012FⅠ期長期跟蹤資料,GC012F在19例受試者中實現了94.7%的ORR,sCR達84.2%,mDoR未達到。安全性方面,3級及以上細胞因子釋放綜合徵(CRS)發生率為10.5%,未觀察到神經毒性。
圖:GC012F結構
資料來源:亙喜生物
(3)CD19×CD20 CAR-T:CD19抗原丟失引起的復發是CD19靶向CAR-T療法治療的一個挑戰。這些患者普遍預後較差,有很高的未滿足醫療需求。CD20是治療B-NHL的一個有效靶標,已在臨床試驗中得到驗證。因此,靶向CD19及CD20的CAR-T細胞療法有望提升對B-NHL的治療效果。
西比曼生物的C-CAR039是一款CD19/CD20雙靶點CAR-T細胞治療產品,目前處於臨床Ⅰ期。在2021 ASCO上,西比曼公佈了C-CAR039用於治療r/r B-NHL的Ⅰ期早期臨床資料,28名患者實現了92.6%的客觀緩解率,其中CR達85.2%。安全性方面,僅1例患者發生了3級CRS,未發生3級及以上免疫效應細胞相關神經毒性綜合徵(ICANS)。
(4)CD33×CLL1 CAR-T:C-型凝集素樣分子1(CLL1)在正常造血幹細胞(HSC)中不表達,但在急性髓性白血病(AML)細胞和白血病幹細胞(LSCs)上高表達,與AML的復發關係密切。CD33在AML細胞中高表達,靶向CD33的ADC藥物Mylotarg已獲批上市。
成都總醫院的劉芳教授在2018年EHA和2019年ASH 上分別了一款CLL1×CD33 CAR-T療法的臨床前及Ⅰ期早期研究資料。截至2019年底,劉芳主任團隊完成9例患者的CLL1-CD33 CAR-T細胞治療,其中7位實現完全緩解(CR)。安全性方面,8例患者出現了CRS,但經過積極的治療和用藥,所有患者的併發症都得到了有效的控制,沒有一例患者因此而死亡。
3
小結
儘管目前全球尚無雙靶點CAR-T獲批上市,但一批企業對雙靶點CAR-T產品寄予厚望,包括傳奇生物、亙喜生物、馴鹿醫療等。從臨床階段的角度,目前絕大多數雙靶點CAR-T細胞療法仍處於臨床早期。從臨床資料的角度,雙靶點CAR-T療法已展現出積極的療效和安全性資料,西比曼生物的C-CAR039獲FDA授予的再生醫學先進療法(RMAT)資格和快速通道(FT)資格、馴鹿醫療的CT120獲FDA孤兒藥資格認定。衷心祝願相關企業再接再厲,憑藉優異的資料快速推進雙靶點CAR-T產品的研發,為晚期血液腫瘤患者提供新的治療手段。