(報告出品方/作者:中信建投證券,賀菊穎、袁清慧、陽明春)
1 ADC藥物:精準制導 + 強效彈頭,佔領靶向藥研發制高點
特異性單抗 + 強效細胞毒藥物,優勢互補協同治療
抗體偶聯藥物(Antibody-Drug Conjugates,ADCs)是指將 高選擇性的 抗體 (Antibody) 和 強力細胞毒藥物(Payload)透過連線鏈(linker)共價 偶聯而得的新型生物藥物。ADCs 結合了單抗對腫瘤細胞的靶向性 & 細胞毒藥 物的強大腫瘤殺傷能力,同時克服了單抗的細胞毒性弱 & 強效細胞毒藥物系統 毒性大的問題,具有巨大治療優勢。
五十餘年的基礎和臨床轉化研究,ADC藥物密集獲批助推領域邁入爆發期。 ADC概念首次提出於1967年,經過漫長的探索研究和Mylotarg撤市風波, 2019年三款ADC藥物的相繼獲批正式標誌著該研發領域邁入爆發期。
ADC 藥物:精準制導 + 強效彈頭
抗體:特異性識別腫瘤表面靶抗原,介導ADC藥物在腫瘤細胞處的定位和內吞 ;
連線鏈:內吞後在腫瘤細 胞內高效釋放細胞 毒藥物,在血液迴圈和靶 外組織細胞中保持穩定 ;
細胞毒藥物:釋放後結合到相應作用位點,發揮強效腫瘤細胞殺傷作用
ADC 開啟泛偶聯時代巨幕,技術積澱助力搶佔下一個制高點
ADC 設計概念的拓展—藉助靶向配體將治療介質選擇性地遞送到疾病灶點處發揮治療效果,催生偶聯藥物技術領域 百花齊放的格局。ADC 藥物作為平臺型技術,先發企業建立的專利技術平臺和研發生產體系,不僅能針對不同靶點 和適應症進行快速開發,也有助於向各種新型偶聯藥物賽道上切換。
2 高技術門檻遍及研發全流程,突顯一站式CXO服務價值
ADC 兼具複雜性和多樣性,CMC/非臨床/臨床研究 均面臨挑戰
ADC 藥物的結構複雜且設計呈現多樣化,為CMC研究相關的生產製造 & 質量控制帶來挑戰;疊加體內作用過程和代 謝過程的複雜性,使非臨床研究 & 臨床研究也面臨挑戰,每一環節的技術門檻都較高。
ADC 生產製造流程複雜,整體工藝與質控體系研發能力關鍵
ADC 藥物生產製造流程包括單抗生產、細胞毒藥物/連線鏈生產、ADC 原液和製品生產三大模組,均須進行工藝開發 與驗證,還須對所用工程細胞、起始原料及試劑制定合理的質量控制要求。 偶聯生產用中間體的質量控制較為靈活,考驗整體工藝與質控體系研發能力。應結合中間體的結構特徵、理化特性、 工藝特點和終產品質控的需要合理選取質控專案並設定限度,決定最終的生產成本和產品質量。 ADC藥物生產多涉及高活性細胞毒藥物,在硬體裝置、流程設計、人員培訓上要求很高,需要大量的資本投入和技術 儲備,生產門檻較高。
ADC關鍵質量屬性繁雜,制定質量控制策略須統攬全域性
單抗本身的異質性 + 偶聯帶來的異質性大幅提高ADC製品的複雜程度,制定質控策略應基於對研發全流程的把控:須綜合利用各種技術手段對關鍵質量屬性進行全面表徵,在充分理解其臨床意義的基礎上,再綜合考慮偶聯用中間體的質量控制、生產批次間一致性、穩定性評價等因素。
3 全球ADC管線深度聚焦腫瘤,早期多樣化靶點蓄勢待發
全球上市註冊及臨床後期ADC藥物仍較少,早期管線擁擠
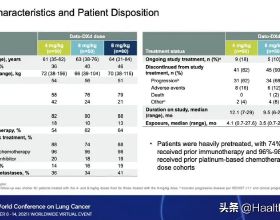
截止2021/08/02,全球處於活躍狀態的 ADC 藥物共 288 個,其中已上市11 個,註冊審批中 1 個、III 期 6 個,II 期 33個,I 期的 51 個,處於臨床前階段的多達186個,未來十年ADC藥物研發仍保持火熱態勢。
全球ADC藥物管線深度聚焦腫瘤領域,實體瘤佔主導
從聚焦的疾病領域來看,ADC 藥物集中度非常高,91.8%集中在腫瘤領域,其次是免疫和肌肉骨骼領域,佔比2.0%。
目前全球ADC藥物開發的主要腫瘤型別中,前十位僅一款血液瘤產品,實體瘤佔主導,包括乳腺癌、非小細胞肺癌、卵巢癌、胃癌、結直腸癌等大適應症,同時也積極攻克胰腺癌治療難題。
全球ADC藥物管線地域集中度高,中美成研發競爭主戰場
從地域分佈來看,美國、中國、韓國、英國、義大利和日本在 ADC藥物研發數量上位居前五:其中美國以153個的絕對優勢位居全球首位,中國以88個位居第二。
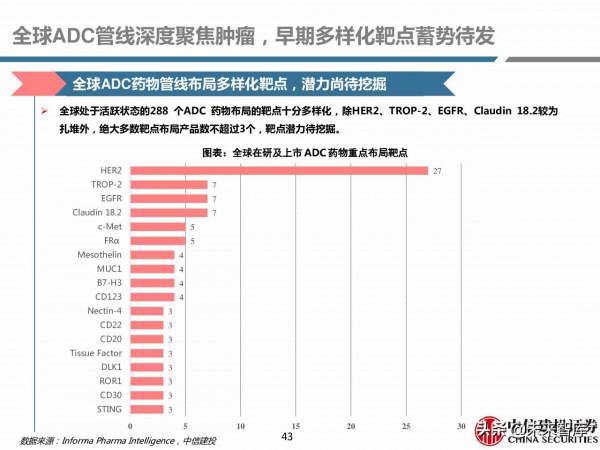
全球ADC藥物管線佈局多樣化靶點,潛力尚待挖掘
全球處於活躍狀態的288 個ADC 藥物佈局的靶點十分多樣化,除HER2、TROP-2、EGFR、Claudin 18.2較為扎堆外,絕大多數靶點佈局產品數不超過3個,靶點潛力待挖掘。
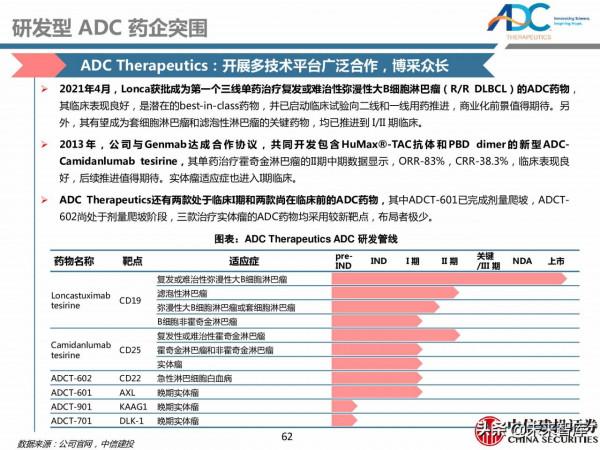
4 研發型 ADC 藥企突圍,跨國藥企積極合作佈局
Seagen:ADC藥物治療先驅,引領ADC研發熱潮
2011年8月, Seagen研發的首款ADC藥物Adcetris獲美國FDA批准上市,成為輝瑞Malotarg退市以來首款上市的ADC藥物,標誌著ADC市場的重啟。隨後,Seagen與武田合作將Adcetris推廣到加拿大、日本、歐盟等40多個國家上市。
2019年12月,Seagen與Astellas合作開發的Padcev加速獲批上市,成為首款靶向Nectin-4治療區域性晚期或轉移性尿路上皮癌的ADC藥物,也是首個獲批用於治療先前接受過鉑化療和PD-1/L1抑制劑治療患者的藥物。
2020年8月,Seagen與GSK合作開發的Blenrep上市,是全球首個靶向BCMA治療成人多發性骨髓瘤的ADC藥物。目前已經上市的11款ADC藥物中, Seagen參與了其中3款藥物的研發。
ImmunoGen:積極授權合作,不懈探索FRα靶點潛力
公司基於細胞毒藥物DM1/DM4技術進行了廣泛合作,除Roche的Kadcyla外還授權給Amgen、Bayer、Sanofi、Novartis、Lilly、Takeda等 跨 國 藥 企。2014年 與CytomX 達 成 交 叉 許 可 協 議 以 共 同 開 發 Probody-drugconjugate療法;與MacroGenics共同開發first-in-class 的ADAM9靶向ADC藥物。
2019年3月,公司宣佈其first-in-class的ADC藥物Mirvetuximab soravtansin (IMGN853) 單藥治療鉑耐藥卵巢癌III期臨床試驗FORWARD I未達到PFS主要終點,成為繼Eisai的Farletuzumab單抗和Merck&Endocyte的Vintafolide小分子藥物後第三家在FRα靶點上栽跟頭的公司。
5 國內藥企自主研發+合作引進,緊隨ADC 行業熱潮
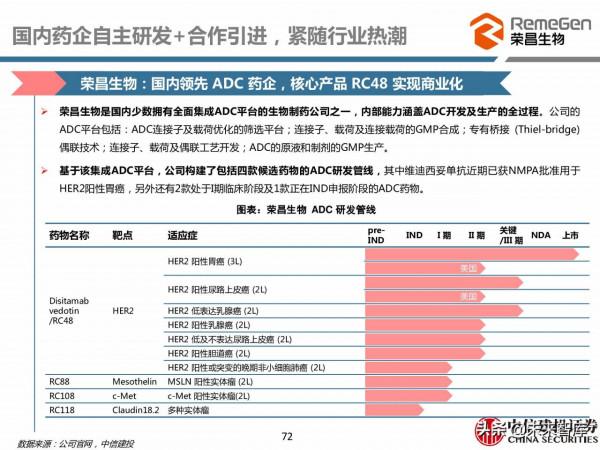
榮昌生物:國內領先 ADC 藥企,核心產品 RC48 實現商業化
榮昌生物是國內少數擁有全面整合ADC平臺的生物製藥公司之一,內部能力涵蓋ADC開發及生產的全過程。公司的ADC平臺包括:ADC連線子及載荷最佳化的篩選平臺;連線子、載荷及連線載荷的GMP合成;專有橋接 (Thiel-bridge)偶聯技術;連線子、載荷及偶聯工藝開發;ADC的原液和製劑的GMP生產。
基於該整合ADC平臺,公司構建了包括四款候選藥物的ADC研發管線,其中維迪西妥單抗近期已獲NMPA批准用於HER2陽性胃癌,另外還有2款處於I期臨床階段及1款正在IND申報階段的ADC藥物。
2021年6月9日,RC48(商品名:愛地希)獲得中國藥監局附條件批准上市,用於HER2過表達區域性晚期或轉移性胃癌患者的三線治療,成為我國ADC藥物領域的首個原創國產新藥。另外,HER2 過表達尿路上皮癌和 HER2 中低表達乳腺癌目前處於臨床 III 期階段,還有多項I/II 期臨床正在推進,其泛癌種治療潛力逐漸凸顯。
RC48作為一款HER2 ADC藥物,所用抗體是人源化IgG1抗體Hertuzumab,其對HER2抗原的親和力更高,同時內吞效果特別好;選擇的細胞毒藥物是MMAE,Linker為mc-vc-PAB可被組織蛋白酶剪下,具有腫瘤旁殺效應;採用半胱氨酸非定點偶聯,DAR值約為4。
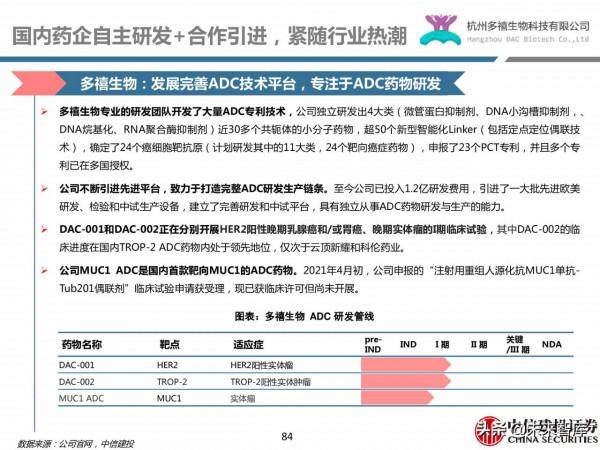
樂普生物:投資併購+技術合作+自主研發,構建差異化管線平臺
2018年樂普生物收購併控股上海美雅珂,獲得後者完全一體化的ADC技術平臺,涵蓋ADC的研究、開發和製造的全過程。其ADC平臺包括 (i)抗體、連線子及有效載荷的工藝開發;(ii)先進的偶聯技術;(iii)實現對DAR進行精確控制的最佳化技術;(iv)抗體、連結體及有效載荷的性質分析及評估;(v)符合cGMP標準的ADC原液及製劑的生產和質量控制。
利用該技術平臺,公司已開發出5款處於臨床階段及1款臨床前的ADC候選藥物,其中MRG003及MRG002已在臨床研究中顯示出良好的療效及安全性。
2019年4月,公司花費1.25億美元從Synaffix B.V.引進其專有的GlycoConnect和 HydraSpace 技術用於下一個臨床候選ADC藥物的開發。這兩項技術能夠直接應用於任何現有抗體,無需額外進行抗體工程化改造,且與所有類別的Payload相容;有望大幅提升ADC的有效性和耐受性,從而開發出同類最佳(best-in-class)的ADC藥物。
MRG002(HER2 ADC)安全性出色,具有較強差異化競爭力。在HER2 ADC細分領域,羅氏的Kadcyla和第一三共的Enhertu已獲批上市,但兩者都有機率出現間質性肺炎這一嚴重不良反應,而MRG002的初步臨床資料沒有報告相關間質性肺炎或眼部疾病等嚴重不良反應,展出了出色的安全性。
報告節選:
(本文僅供參考,不代表我們的任何投資建議。如需使用相關資訊,請參閱報告原文。)
精選報告來源:【未來智庫官網】。