撰文 | 小黑背鷗
責編 | 翊竑
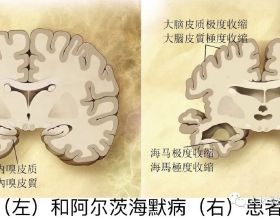
阿爾茲海默症(Alzheimer's disease, AD)是一種嚴重且不可逆轉的漸進性腦部疾病,我們俗稱其為“老年痴呆症”。它是60-70%痴呆症的成因。阿爾茲海默症使患者記憶力衰退、學習能力逐漸減弱,隨著疾病進展,症狀還會演化為定向障礙(容易迷路)、情緒波動、失去動力等情況,對患者、患者家庭以及社會造成極大影響。
現如今暫沒有治療手段可以阻止或逆轉阿爾茲海默症的進展,僅有少部分治療可能會暫緩其症狀。如今,AD已經是發達國家最常見的 10 種致命疾病之一,截至2015年,全球約有 2980 萬人患有AD。阿爾茨海默病對社會造成的經濟負擔巨大,據估計,晚年痴呆症(其中 AD 約佔 60%)給社會帶來的經濟負擔預計將超過心臟病和癌症 。
在2021年7月6日,美國食品藥品管理局FDA批准了一款治療阿爾茲海默症的藥物:Aducamumab (商品名:Aduhelm) 用於治療阿爾茲海默症。Aduhelm基於降低大腦中一種替代性終點的指標——病理性的β-澱粉樣蛋白(Aβ),從而對阿爾茲海默症進行臨床治療。Aduhelm審批的透過代表了首個被批准用於阿爾茨海默病的治療方法的認可,這是自 2003 年以來首個獲批用於阿爾茨海默氏症的新療法,也是首個針對該疾病基本病理生理學的療法【1】(詳見BioArtMED既往報道:Science | 針對澱粉樣蛋白的免疫治療或將成為首個針對AD的疾病修飾療法)。
“Aducanumab能夠減少大腦中β-澱粉樣蛋白斑塊的含量,對於阿爾茲海默症患者而言,這些斑塊的減少能夠緩解或阻止患者認知水平的降低,對阿爾茲海默症的臨床治療產生巨大的益處。”這似乎聽上去很合理,但事實真正如此嗎?在2021年9月14日,來自法國巴黎記憶和阿爾茨海默病研究所的Nicolas Villain與來自波爾多大學的Vincent Planche聯合在JAMA Neurology發表評論 US Food and Drug Administration Approval of Aducanumab—Is Amyloid Load a Valid Surrogate End Point for Alzheimer Disease Clinical Trials 就阿爾茲海默症替代性臨床終點澱粉樣蛋白斑塊水平的降低與患者實際認知水平的關係展開討論,並對以往觀點進行總結與質疑。
在阿爾茲海默症的研究中,研究人員經常使用β-澱粉樣蛋白斑塊水平、Tau蛋白水平作為替代終點來對臨床效益進行預測。什麼是替代終點?方法學家在二十世紀八十年代後期對其進行了首次定義——替代標誌必須在臨床效益上調節治療效果【2】。我們需要明白,替代終點的意義在於預測臨床益處,其本身並不是臨床益處的一項指標。
對於阿爾茲海默症而言,若我們將澱粉樣蛋白斑塊水平作為替代終點,則需要滿足以下要求:
1. 治療對認知功能減退有影響;
2. 減緩認知下降的治療效果被澱粉樣蛋白的載荷所拮抗;
3. 治療對降低大腦中的澱粉樣蛋白水平有影響;
4. 澱粉樣蛋白的載荷與認知能力下降有關;
圖1. 阿爾茲海默症替代終點的標準圖示
若考慮到替代終點的如此定義,那我們應該如何理解抗澱粉樣蛋白療法、澱粉樣蛋白載荷以及潛在臨床結果的關係呢?
首先,若我們要使用澱粉樣蛋白的載荷作為替代終點,則需要提前進行一項臨床試驗,證明抗澱粉樣蛋白治療可以減少認知能力下降。這是在該陽性試驗的框架內評估替代標記物的先決條件,然而,到目前為止,沒有任何一項使用抗澱粉樣蛋白療法的3期臨床試驗被證明是陽性的,這是明確且清晰的。
即使最近的Donanemab【3】和Lecanemab【4】藥物在2期臨床試驗中顯示陽性結果,彷彿符合這一替代終點的標準,但這忽視了在早期的阿爾茲海默症中有關Aducanumab的臨床3期試驗(BIIB037)和其他抗澱粉樣蛋白臨床試驗中陰性結果(其原因可能是低下的藥效學潛力、較低的藥物劑量、錯誤的目標人群)。
其次,即使我們認為現有的關於Donanemab、Lecanemab 以及Aducanumab的臨床試驗提供的陽性結果可以證明:抗澱粉樣蛋白療法能夠透過降低患者大腦中的澱粉樣蛋白載荷來減少認知水平的降低,而不是透過降低其他的、更多因果性的間接性替代標記。但事實是,Biogen並沒有提供有關Aducanumab的這些資訊,而FDA公共資料或表明相反的結果。
雖然目前缺乏關於澱粉樣蛋白載荷降低的調節阿爾茲海默症治療效果和患者認知水平下降之間的資料,但是在先前的抗澱粉樣蛋白的臨床試驗中的一些例項足以強調:三者之間或許沒有這種直接調解效果。儘管在臨床試驗中,澱粉樣蛋白的載荷量顯著降低,但相關的陽性、陰性的免疫學治療手段並無法證實其臨床效益【5-6】。
最後,雖然如今已證實Aducanumab能夠減少患者大腦中的澱粉樣蛋白的載荷,但之前有研究發現——澱粉樣蛋白載荷量與認知水平的直接聯絡十分低下。進一步的研究發現,60歲以上的認知功能未受損的個體,即使其大腦中有澱粉樣蛋白的病理證明,但其發展為症狀性阿爾茲海默症的終生風險都小於50%,並且在接下來的1或2年內,Tau蛋白的累積並不會顯著增加【7】。
我們可以得到一個清晰的結論——迄今為止,在阿爾茲海默症的治療實驗中並沒有有效的臨床替代終點指標。即使日後需要使用替代終點,也需要在研究開始前先證實其的可靠性。
FDA的決定為該領域提出了一個很好的問題:“什麼是未來阿爾茨海默病臨床試驗的良好替代終點?”事實上,就與認知水平的下降關係而言,透過評估神經退行性病變或Tau蛋白的病理水平遠比測量澱粉樣蛋白的載荷量要準確的多。
所有潛在的替代終點標記物都應該進行仔細的審視(如當下正在進行的有關Donanemab、Lecanemab 以及Aducanumab的臨床試驗),並使用大量的樣本試驗對其進行檢驗,使得他們在未來能夠成為可靠且有效的替代終點。
嚴格的方法對於替代終點的發展意義重大,在Aducanumab獲得FDA審批之際,作者回過頭來向醫學界提出了一個重要的問題——“澱粉樣蛋白的載荷量降低就能夠等同於治療阿爾茲海默症嗎?”,Aduhelm需要進行確認性臨床試驗,證明Aduhelm對AD患者認知能力方面的臨床益處,這是重要且必要的。
本文來自BioArtMED微信公眾號,更多生物領域前沿資訊等你來發現!
轉載須知
【原創文章】BioArtMED原創文章,歡迎個人轉發分享,未經允許禁止轉載,所刊登的所有作品的著作權均為BioArtMED所擁有。BioArtMED保留所有法定權利,違者必究。