肥厚型心肌病(hypertrophic cardiomyopathy,HCM)是最為常見的單基因遺傳性心臟疾病,是年輕人猝死的首要原因【1】。HCM目前主要根據臨床表現進行對症治療以延緩疾病進展,無法實現逆轉或者根治。近年來,隨著基因檢測技術的發展和普及,HCM的篩查和診斷有了長足的進步。先證者家族中的攜帶者能被高效的檢出,但在症狀出現之前仍缺乏預防性治療手段。
2021年9月16日,中國醫學科學院阜外醫院蘭峰教授,復旦大學王永明教授以及首都醫科大學附屬北京安貞醫院張宏家教授,在Circulation Research 線上發表了題為Efficient correction of a hypertrophic cardiomyopathy mutation by ABEmax-NG的文章。該研究首次使用鹼基編輯技術ABEmax-NG 直接糾正 HCM 小鼠模型胚胎中的致病性R404Q/+ 突變(Myh6 c.1211C>T),根除了疾病表型,並與ssODN介導的同一位點修復進行了系統的比較,評估了ABEmax-NG編輯的效率和安全性。
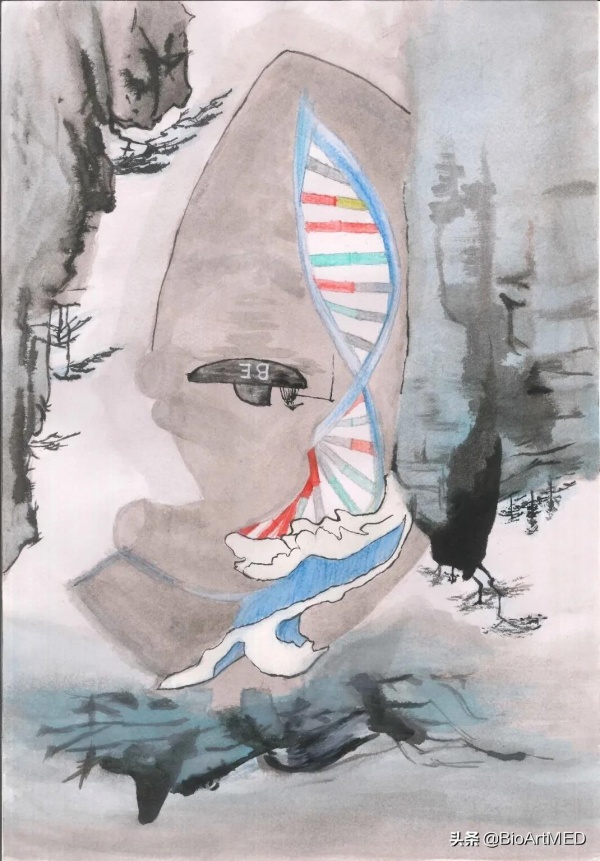
圖文摘要
該研究獨立研發了具有擴充套件PAM區的ABEmax-NG系統,此係統透過修復胚胎基因,有效地糾正致病性 Myh6 R404Q/+突變,從而防止F0 和 F1 代小鼠發生HCM。與ssODN介導的同源重組修復相比,ABEmax-NG 在不引入插入/缺失的情況下顯示出更高的修復率(高於70%)。對出生小鼠進行的治療後監測並未顯示出明顯的產前或產後發育異常或可檢測的遺傳病變。而針對同一位點同時進行的編輯,雖然效率達到100%,但僅會產生30%的修復比例,餘下的70%為鹼基插入和刪除(Indel),說明其安全性仍不足以被應用於臨床。此外,該研究還探究了在子宮內用 AAV9-ABEmax-NG 編輯 Myh6 突變等位基因的可行性,並觀察到 Myh6 R404Q/+ 和 Fam178b 心臟組織的修復。以上結果表明ABEmax-NG能夠有效的在體內修復造成HCM的基因突變,並且其安全性相對於ssODN方法大大提升。
種系基因治療(Germline gene therapy,GGT)透過糾正精子、卵子或胚胎中的致病突變可有效地阻斷遺傳疾病從父母遺傳給孩子【2】。GGT已展現出了極為可觀的運用前景:例如,2017 年墨西哥研究人員首次成功地將 GGT 用於治療 Leigh 綜合徵,將供體 mtDNA 取代了致病的mtDNA突變,並最終誕生了一個健康的男孩【5】。基於此治療研究,英國隨後批准在臨床試驗中使用GGT來治療線粒體DNA突變【6】。然而,CRISPR/Cas9-ssODN介導的GGT在糾正基因突變的同時,也極有可能會引入DNA的插入或缺失,甚至染色體的丟失,產生不可預測的突變,使其在臨床的轉化應用也受到了極大的限制【3】。鹼基編輯器(base editors,BEs)在不需要提供額外修復模板的同時,能夠轉換特定的單個核苷酸鹼基對,且不會造成目的基因的插入、缺失或染色體丟失【4】。本研究首次採用基於BEs的GGT,並且在HCM動物模型中驗證了其有效性和安全性,揭示了這一新技術的臨床應用前景。
在方法學創新之外,該研究透過設計打靶策略,發現ABEmax-NG 在GGT中可以高效的無差別編輯具有不同PAM (NG) 和染色體分佈的目標基因座,為鹼基編輯介導的GGT提供了基礎理論支撐。同時,在ssODN模板介導的HDR之外,Cas9介導的非同源末端重組(NHEJ)僅識別和編輯單鹼基差異的404Q 等位基因,破壞突變等位基因,也能夠使WT 等位基因恢復正常基因功能進而消除表型,也提示了可能的基因編輯治療新策略。
文章的第一作者為蘭峰課題組博士研究生馬樹紅,安貞醫院姜文劍醫師和阜外醫院劉旭傑副研究員。蘭峰教授、王永明教授和張宏家教授為通訊作者。
本文來自BioArtMED微信公眾號,更多生物領域前沿資訊等你來發現!
轉載須知
【原創文章】BioArtMED原創文章,歡迎個人轉發分享,未經允許禁止轉載,所刊登的所有作品的著作權均為BioArtMED所擁有。BioArtMED保留所有法定權利,違者必究。