藥物遞送系統是旨在減少藥物脫靶毒副作用的精準醫學的聖盃。然而,諸如合成奈米載體或脂質奈米顆粒等藥物遞送系統在防止對載體產生不必要的免疫反應以及以可控方式釋放藥物的機制方面持續遇到挑戰。
最近的研究表明,我們體內最豐富的細胞:血細胞可能是一個更好的選擇,其中,尤其紅細胞和血小板在這一領域表現出良好的前景。與我們的大多數細胞不同,它們不攜帶遺傳物質,這使得它們不太可能受到免疫系統的攻擊。
此外,血細胞在血液中可存續數天到數月,其中紅細胞平均存活4個月,這意味著他們可以在很長一段時間內持續遞送藥物。最後,血細胞可以很容易地從捐獻者身上提取,並在裝載藥物後輸入患者體內。
紅細胞藥物遞送
紅細胞也稱紅血球,自20世紀70年代研究人員首次能夠將酶包埋在紅細胞內以來,其一直被研究作為治療藥物的載體。然而,在80年代和90年代,對透過輸血傳播的疾病(如艾滋病)越來越嚴格的審查減緩了該領域的進展。最近,隨著對細胞和基因治療的興趣增加,生物技術研究人員和公司正在開發在紅細胞內裝載一系列治療實體的方法。
現階段,紅細胞療法相關公司的技術路徑主要還是圍繞兩個方式展開:1)利用完整的紅細胞直接負載藥物;2)以幹細胞作為來源的工程化紅細胞負載藥物。
隨著幹細胞、基因編輯等技術逐步走向成熟,幹細胞衍生的工程化紅細胞技術得到了飛速發展。透過在體外對造血幹細胞進行重程式設計,再配合基因編輯技術將編碼藥物的目的基因匯入造血幹細胞,隨後進行培養、分化和成熟,從而可以直接產生負載藥物的紅細胞。美國臨床階段的紅細胞療法公司Rubius Therapeutics 是這一技術的開創者。
Rubius目前重點佈局了癌症和自身免疫疾病領域。其領先候選產品為用於復發/難治性急性髓系白血病和實體瘤的RTX-240。研發管線中還有另外3款紅細胞候選產品,分別是針對HPV 16陽性腫瘤的RTX-321 (RTX-aAPC) 、 用於實體瘤的RTX-224和用於1型糖尿病的RTX-T1D。
Rubius研發管線(來源:Rubius Therapeutics官網)
利用完整的紅細胞直接負載藥物的技術領域則起步較早,全球約有7 家企業的技術發展相對成熟,其中EryDel、EryTech等公司已有產品處於臨床試驗階段。
EryDel 是一家利用人體成熟紅細胞遞送藥物的義大利生物技術公司,其專有平臺技術是一種易於使用、快速且自動的程式,可以將包括治療酶在內的大分子和小分子封裝在患者的紅細胞中。隨後,這些細胞立即被重新注入患者體內,從而延長了其在血液中的半衰期,降低了免疫原性,具有更好的耐受性和可預測的血管分佈。
EryDel的執行長Luca Benatti 解釋說:“我們的技術需要一個專有的紅細胞loader和一個一次性工具包,其中包含一個離心碗、一個封閉的管道系統,以及提供滲透步驟條件以開啟紅細胞膜孔隙的不同溶液。將藥物裝入紅細胞後,在回輸患者體內之前,使用另一種溶液重新密封細胞膜。”
值得關注的是,目前用於治療酶缺乏症的療法通常會在體內引發免疫反應,使酶的效果降低,並導致嚴重的副作用。EryDel的技術平臺還可以利用患者自身的紅細胞封裝蛋白質,有望保護酶免受免疫反應,發揮其預期的治療效果,從而為罕見的酶缺乏症(一個需求高度未滿足的領域)提供新的治療方法。
目前,EryDel 共有 8 種在研藥物,主要致力於罕見病藥物的開發。包含 EE-TP(線粒體神經胃腸道腦病)、Ery-PAL(苯丙酮尿症)、Ery-uricase(難治性痛風)、Ery-GAMT(胍基乙酸N-甲基轉移酶缺乏症)等。
EryDel產品管線(來源:EryDex官網)
其中,將地塞米松磷酸鈉負載到自體紅細胞中治療共濟失調毛細血管擴張症的領先產品EryDex,已經進入III 期臨床(NCT02770807)。
另一家致力於紅細胞療法的公司是法國生物技術公司EryTech。雖然這家公司專有的ERYCAPS 平臺也使用滲透性溶液將藥物封裝在紅細胞內,但其藥物開發管線的重點是癌症。
EryTech已開發出一系列針對市場上醫療需求未得到滿足的候選產品。其中主要候選產品為Eryaspase,由封裝在供體來源的紅細胞內的 L-天冬醯胺酶組成,主要針對癌細胞改變的天冬醯胺和谷氨醯胺代謝。
EryTech執行長Gil Beyen解釋說:“我們的目標是將紅細胞轉化為‘製藥廠’,剝奪癌細胞的重要營養素——天冬醯胺。這項技術將天冬醯胺酶封裝在紅細胞內,紅細胞自然具有活性泵將底物天冬醯胺帶入體內。一旦注射到血液中,紅細胞將在大約3周的半衰期內迴圈,並將作為‘迴圈生物反應器’,在較長時間內降低天冬醯胺水平。”
EryTech產品管線(來源:EryTech官網)
Eryaspase在二線胰腺癌治療方面正處於III期臨床階段,在三陰性乳腺癌治療方面處於II期臨床階段。
需要注意的是,儘管利用紅細胞遞送藥物大有潛力,但並非沒有限制。首先,用於裝載藥物的滲透衝擊可能會不可逆地損害某些細胞的細胞膜。其次,藥物可能在到達靶點之前擴散出紅細胞,造成副作用。當然,許多新的方法解決了這些問題,但尚未得到臨床驗證。這些措施包括在細胞表面裝載藥物以避免損傷細胞,以及在合成奈米載體上塗覆紅細胞碎片以逃避免疫系統。
血小板藥物載體
血小板的平均壽命為10天,它在血液中的迴圈時間不如紅細胞長。但是,它們的儲存容量很高,可以承載多種貨物。血小板在人體血管系統中巡邏以檢測和修復洩漏的血管,這使它們成為靶向損傷部位並釋放內容物的理想候選者。
使用血小板的藥物遞送系統落後於紅細胞,其中最領先的仍處於臨床前開發階段。不過,由於Plasfer、PlateletBio和Cellphire Therapeutics等公司的努力,他們正在迅速趕上。
Plasfer是一家臨床前階段的義大利生物製藥公司,憑藉以血小板為中心的科學知識,公司團隊專注於生產細胞藥物,旨在治療一系列醫療需求未得到滿足的疾病。
動圖來源:Plasfer官網
Plasfe開發並獲得專利的技術平臺血小板轉移技術(PTTTM)能夠高效地設計人類和鼠血小板以非常高的效率轉染遺傳物質 (mRNA、siRNA、microRNA、質粒DNA) 以及其他類別分子。
Plasfer的血小板療法由自體或同種異體血小板組成。這些血小板經過工程設計,可在其內部或細胞表面高效表達並遞送不同類別的治療分子。該公司執行長Marco Malvesti說:“當想用血小板作為抗原呈遞細胞時,我們可以將藥物裝載到細胞表面。當想用血小板進行藥物遞送時,我們可以將藥物封裝在血小板內。”
Plasfer產品管線 (來源:Plasfer官網)
同樣,使用血小板遞送藥物有很多優勢:1)與紅細胞一樣,使用血小板遞送可避免免疫系統的攻擊;2)血小板也能以類似於合成奈米顆粒的較小形式遞送藥物;3)由於血小板對某些型別的組織以及癌症、傷口和病原體具有天然歸巢作用,因而可以減少細胞療法的脫靶效應;4)除了傷口和癌症,這項技術還可以應用於再生醫學和心血管疾病。
但有兩個潛在問題也需注意。首先,由於血小板在血凝塊形成中的作用,它們有導致過度凝血或進一步惡化本應治療疾病(如某種形式血癌)的風險。其次,用藥物裝載血小板可能會縮短血小板的壽命。
其他血細胞和優秀載體
白細胞(白血球)也是藥物遞送的候選細胞。它們具有粘附性,能粘附在血管壁上,此外還具有對癌症和炎症部位的固有歸巢能力,能使藥物遞送更加精確。然而,這種遞送方法的商業可行性仍然是一個遙遠的目標,因為在提取白細胞時,批次之間存在很多差異。作為替代方案,研究人員正嘗試用來源於白細胞的成分包覆奈米載體。
在白細胞型別中,中性粒細胞和單核細胞在藥物輸送方面尤其有用。作為免疫系統的第一應答者,中性粒細胞是最早到達炎症部位的細胞。
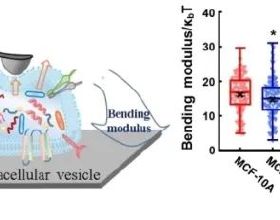
2021年7月31日,瀋陽藥科大學的研究人員在Acta Biomaterialia雜誌上發表文章,展示了他們構建的中性粒細胞和單核細胞 (N/Ms) 為載體的藥物遞送平臺。該平臺透過合成的唾液酸-硬脂酸結合物特異性結合N/Ms,以對脂質體表柔比星進行表面修飾,透過迴圈N/Ms增強脂質體的內吞作用,且負載脂質體表柔比星的N/Ms依舊能維持其對腫瘤的固有趨化性。
來源:Acta Biomaterialia
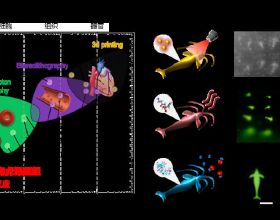
在荷瘤小鼠中,與其他製劑相比,脂質體表柔比星顯著提高了腫瘤靶向效率和治療效果,甚至根除了腫瘤,因為含有脂質體表柔比星的N/Ms具有腫瘤聚集和抑制作用。
來源:Acta Biomaterialia
這項研究表明,作為藥物遞送載體的N/Ms具有巨大的臨床應用潛力。
小結
不可否認,無論何種型別血細胞,使用患者自身血細胞作為藥物載體的使用仍然限於小規模使用。與其他形式的細胞療法一樣,基於血細胞療法的商業化面臨一些重大挑戰,包括擴大生產和長期儲存。值得期待的是,將來使用供體細胞製作的現貨型療法可能會解決其中一些問題。
參考資料:
1# Blood Cells: The Future of Drug Delivery(來源:LABIOTECH.eu)
2# Junqiang Ding et al. Sialic acid conjugate-modified liposomes enable tumor homing of epirubicin via neutrophil / monocyte infiltration for tumor therapy. Acta Biomaterialia. (2021)
3# 紅細胞療法異軍突起!國外先驅公司Rubius公佈積極抗癌證據、國內領頭公司再獲億元融資(來源:醫藥魔方Pro)
4# 各公司官網