鋰是一種金屬元素,元素符號為Li,對應的單質為銀白色質軟金屬,也是密度最小的金屬。用於原子反應堆、制輕合金及電池等。鋰和它的化合物並不像其他的鹼金屬那麼典型,因為鋰的電荷密度很大並且有穩定的氦型雙電子層,使得鋰容易極化其他的分子或離子,自己本身卻不容易受到極化。這一點就影響到它和它的化合物的穩定性。
由於電極電勢最負,鋰是已知元素(包括放射性元素)中金屬活動性最強的。
2018年8月,中科院國家天文臺科研人員為首的團隊依託LAMOST發現一顆奇特天體,其鋰元素含量約是同類天體的3000倍,是人類已知鋰元素丰度最高的恆星 。
第一塊鋰礦石,透鋰長石(LiAlSi4O10)是由巴西人在名為Utö的瑞典小島上發現的,於18世紀90年代。當把它扔到火裡時會發出濃烈的深紅色火焰,斯德哥爾摩的Johan August Arfvedson分析了它並推斷它含有以前未知的金屬,他把它稱作lithium(鋰)。他意識到這是一種新的鹼金屬元素。然而,不同於鈉的是,他沒能用電解法分離它。1821年William Brande電解出了微量的鋰,但這不足以做實驗用。直到1855年德國化學家 Robert Bunsen和英國化學家Augustus Matthiessen電解氯化鋰才獲得了大塊的鋰。鋰的英文為Lithium,來源於希臘文lithos,意為“石頭”。Lithos的第一個音節發音“裡”。因為是金屬,在左方加上部首“釒”。鋰在地殼中的含量比鉀和鈉少得多 ,它的化合物不多見,是它比鉀和鈉發現的晚的必然因素。鋰發現的第二年,得到法國化學家伏克蘭重新分析肯定。
鋰,原子序數3,原子量6.941,是最輕的鹼金屬元素。元素名來源於希臘文,原意是“石頭”。1817年由瑞典科學家阿弗韋聰在分析透鋰長石礦時發現。自然界中主要的鋰礦物為鋰輝石、鋰雲母、透鋰長石和磷鋁石等。在人和動物機體、土壤和礦泉水、可可粉、菸葉、海藻中都能找到鋰。天然鋰有兩種同位素:鋰-6和鋰-7。
金屬鋰為一種銀白色的輕金屬;熔點為180.54°C,沸點1342°C,密度0.534克/釐米³,硬度0.6。金屬鋰可溶於液氨。鋰與其它鹼金屬不同,在室溫下與水反應比較慢,但能與氮氣反應生成黑色的一氮化三鋰晶體。鋰的弱酸鹽都難溶於水。在鹼金屬氯化物中,只有氯化鋰易溶於有機溶劑。鋰的揮發性鹽的火焰呈深紅色,可用此來鑑定鋰。鋰很容易與氧、氮、硫等化合,在冶金工業中可用做脫氧劑。鋰也可以做鉛基合金和鈹、鎂、鋁等輕質合金的成分。鋰在原子能工業中有重要用途。
2018年8月,由中國科學院國家天文臺帶領的科研團隊依託大科學裝置郭守敬望遠鏡(LAMOST)發現一顆奇特天體,它的鋰元素含量約是同類天體的3000倍,絕對鋰丰度高達4.51,是人類已知鋰元素丰度最高的恆星。這一重要天文發現於北京時間8月7日凌晨,在國際科學期刊《自然·天文》(Nature Astronomy)上線上釋出 。
含量分佈
在自然界中,主要以鋰輝石、鋰雲母及磷鋁石礦的形式存在。
鋰在地殼中的自然儲量為1100萬噸,可開採儲量410萬噸。2004年,世界鋰開採量為20200噸, 其中,智利開採7990噸,澳大利亞3930噸,中國2630噸,俄羅斯2200噸,阿根廷1970噸。
鋰號稱“稀有金屬”,其實它在地殼中的含量不算“稀有”,地殼中約有0.0065%的鋰,其丰度居第二十七位。已知含鋰的礦物有150多種,其中主要有鋰輝石、鋰雲母、透鋰長石等。海水中鋰的含量不算少,總儲量達2600億噸,可惜濃度太小,提煉實在困難。某些礦泉水和植物機體裡,含有豐富的鋰。如有些紅色、黃色的海藻和菸草中,往往含有較多的鋰化合物,可供開發利用。中國的鋰礦資源豐富,以中國的鋰鹽產量計算,僅江西雲母鋰礦就可供開採上百年。
理化性質
物理性質
銀白色金屬。質較軟,可用刀切割。是最輕的金屬,密度比所有的油和液態烴都小,故應存放於固體石蠟或者白凡士林中(在液體石蠟中鋰也會浮起)。
鋰的密度非常小,僅有0.534g/cm³,為非氣態單質中最小的一個。
因為鋰原子半徑小,故其比起其他的鹼金屬,壓縮性最小,硬度最大,熔點最高。
溫度高於-117℃時,金屬鋰是典型的體心立方結構,但當溫度降至-201℃時,開始轉變為面心立方結構,溫度越低,轉變程度越大,但是轉變不完全。在20℃時,鋰的晶格常數為3.50Å,電導約為銀的五分之一。鋰容易與鐵以外的任意一種金屬熔合。
鋰的焰色反應為紫紅色。
同位素
鋰共有七個同位素,其中有兩個是穩定的,分別是 Li-6和Li-7,除了穩定的之外,半衰期最長的就是Li-8,它的半衰期有838毫秒,接下來是Li-9,有187.3毫秒,之後其他的同位素半衰期都在8.6毫秒以下。而Li-4是所有同位素裡面半衰期最短的同位素,只有 7.58043×10-23秒。
Li-6捕捉低速中子能力很強,可以用來控制鈾反應堆中核反應發生的速度,同時還可以在防輻射和延長核導彈的使用壽命方面及將來在核動力飛機和宇宙飛船中得到應用。Li-6在原子核反應堆中用中子照射後可以得到氚,而氚可用來實現熱核反應。Li-6在核裝置中可用作冷卻劑。
化學性質
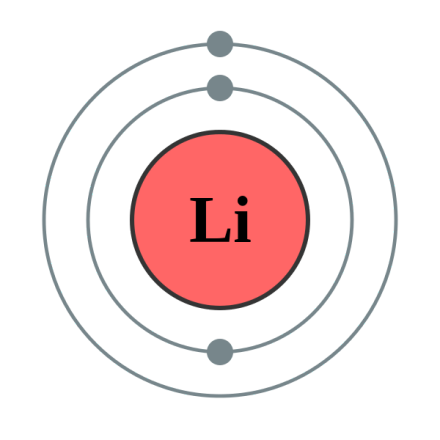
鋰的電子排布
鋰(Lithium),是一種化學元素,是金屬活動性較強的金屬(金屬性最強的金屬是銫),它的化學符號是Li,它的原子序數是3,三個電子其中兩個分佈在K層,另一個在L層。鋰是所有金屬中最輕的。因為鋰的電荷密度很大並且有穩定的氦型雙電子層,使得鋰容易極化其他的分子或離子,自己本身卻不容易極化。這一點就影響到它和它的化合物的穩定性。
鋰在空氣中燃燒
雖然鋰的氫標電勢是最負的,已經達到-3.045,但由於氫氧化鋰溶解度不大而且鋰與水反應時放熱不能使鋰融化,所以鋰與水反應還不如鈉劇烈,反應在進行一段時間後,鋰表面的氮氧化物膜被溶解,從而使反應更加劇烈。在500℃左右容易與氫發生反應,產生氫化鋰,是唯一能生成穩定得足以熔融而不分解的氫化物的鹼金屬,電離能5.392eV,與氧、氮、硫等均能化合,是唯一的與氮在室溫下反應,生成氮化鋰(Li₃N)的鹼金屬。由於易受氧化而變暗。如果將鋰丟進濃硫酸,那麼它將在硫酸上快速浮動,燃燒並爆炸。如果將鋰和氯酸鉀混合(震盪或研磨),它也有可能發生爆炸式的反應。
鋰的一些反應的化學反應方程式:
氫化鋰遇水發生猛烈的化學反應,產生大量的氫氣。兩公斤氫化鋰分解後,可以放出氫氣5.66千升。氫化鋰的確是名不虛傳的“製造氫氣的工廠”。第二次世界大戰期間,美國飛行員備有輕便的氫氣源——氫化鋰丸作應急之用。飛機失事墜落在水面時,只要一碰到水,氫化鋰就立即與水發生反應,釋放出大量的氫氣,使救生裝置(救生艇、救生衣、訊號氣球等)充氣膨脹。
製取方法
1855年,本生和馬奇森採用電解熔化氯化鋰的方法才製得它,工業化制鋰是在1893年由根莎提出的,鋰從被認定是一種元素到工業化製取前後歷時76年。電解氯化鋰製取鋰要消耗大量的電能,每煉一噸鋰就耗電高達六、七萬度。
工業上可以用如下的方法制備鋰單質:
將氯化鋰在不超過其熔點(602℃)的溫度下灼燒乾燥1h。
使用經過氫氧化鉀脫水乾燥的、新蒸餾的吡啶溶解上述氯化鋰,製成11.81%的氯化鋰的吡啶溶液作為電解液。用石墨板作陽極,光潔的鉑片或鐵片作陰極,無隔膜。電解時採用的電壓為1.4V,電流密度為0.2~0.3A/100cm3。