又是一週腫瘤藥訊時間,轉眼已經10月中旬,氣溫迅速轉涼,腫瘤藥界卻仍火熱一片!這周NMPA表現不俗,澤璟又一新適應症上市,用於治療甲狀腺癌;Ⅱ、ⅢA期非小細胞肺癌又取得突破性進展……千萬別錯過這些新鮮資訊,小編速來和您分享!
FDA 批准 Abemaciclib 加內分泌的伴隨診斷,治療早期乳腺癌
2021 年 10 月 15 日,FDA 批准 Ki-67 IHC MIB-1 pharmDx(Dako Omnis)測試,來幫助確定哪些疾病復發風險高的早期乳腺癌患者可能會受益於 abemaciclib(Verzenio)加內分泌治療的輔助治療。
批准是根據一項開放標籤、全球、3 期試驗 (NCT03155997) 。試驗招募了18 歲且患有激素受體陽性、HER2 陰性疾病的患者,在隨機化之前,患者接受長達 12 周的內分泌治療、放療以及輔助和新輔助化療。如果患者患有隱匿性乳腺癌、轉移性疾病或淋巴結陰性疾病,則將其排除在外。
試驗共納入5637 名患者,他們以 1:1 的比例隨機接受 abemaciclib 加內分泌治療(n = 2794)或單獨的內分泌治療(n = 2797)。該試驗的主要終點是侵襲性無病生存期(iDFS)。一個關鍵的次要終點是遠處無復發生存。其他終點包括總生存期 (OS)、安全性、藥代動力學和患者報告的結果。
根據最新資料顯示,在 2003 名具有高復發風險且 Ki-67 評分為 20% 或更高的患者中,在內分泌治療中加入 CDK4/6 抑制劑導致 iDFS(HR , 0.626; 95% CI, 0.488-0.803; P = 0.0042)。研究組的 36 個月 iDFS 率為 86.1%(95% CI,82.8%-88.8%),而對照組為 79.0%(95% CI,75.3%-82.3%)。
NMPA受理了多納非尼新藥上市申請新藥上市,治療甲狀腺癌
2021 年 10 月 15 日,NMPA受理了澤璟生物的多納非尼新藥上市申請,用於治療區域性晚期/轉移性放射性碘難治性分化型甲狀腺癌(RAIR-DTC)適應症。
甲苯磺酸多納非尼片是澤璟製藥開發的具有獨立自主智慧財產權的口服多靶點、多激酶抑制劑類小分子抗腫瘤藥物,屬於 1 類新藥。該藥已經被證明是一個療效確切、安全性良好、患者可及和風險獲益平衡良好的晚期肝癌一線治療靶向新藥。早在2021 年 6 月,多納非尼適應症首次獲批上市,一線治療晚期肝細胞癌。
CHMP批准帕博利珠單抗+樂伐替尼 用於特定 RCC 和子宮內膜癌
2021 年 10 月 16 日,歐洲藥品管理局人用藥品委員會 (CHMP) 已就批准帕博利珠單抗 (Keytruda) 和樂伐替尼 (Lenvima) 聯合用於 2 個適應症:選擇腎細胞癌 (RCC) 患者和選擇患者根據默克公司的公告,患有子宮內膜癌。
第一個正面意見是基於 CLEAR/KEYNOTE-581 3 期試驗 (NCT02811861) 的資料,在晚期 RCC 成人患者的一線治療中使用雙藥。在該人群中,與舒尼替尼 (Sutent) 相比,帕博利珠單抗加樂伐替尼可使死亡風險降低 34%(HR,0.66;95% CI,0.49-0.88;P =0 .0049)。
與舒尼替尼相比,雙藥治療還提高了中位無進展生存期,分別為 23.9 個月(95% CI,20.8-27.7)和 9.2 個月(95% CI,6.0-11.0)(HR,0.39;95% CI,0.32-0.49) ; P <0 .0001)。聯合治療的確認客觀緩解率 (ORR) 也證明比單藥治療更高,分別為 71% (95% CI, 66%-76%) 和 36% (95% CI, 31%-41%) .
具體而言,與研究者選擇的化療方案(多柔比星或紫杉醇)相比,雙聯藥物可使死亡風險降低 38%。研究組的中位 OS 為 18.3 個月,而對照組為 11.4 個月(HR,0.62;95% CI,0.51-0.75;P <0.0001)。與化療相比,派姆單抗加樂伐替尼還使疾病進展或死亡的風險降低了 44%。研究組和對照組的中位 PFS 分別為 7.2 個月和 3.8 個月(HR,0.56;95% CI,0.47-0.66;P <0.0001)。
FDA 批准 Atezolizumab 輔助治療,用於 II 至 IIIA 期非小細胞肺癌
2021 年 10 月 16 日,FDA 批准了 atezolizumab (阿替利珠單抗,T藥) 用作切除術和鉑類化療後的輔助治療以及由 Ventana Medical Systems, Inc. 開發的 VENTANA PD-L1 (SP263) 檢測裝置,用作輔助診斷裝置用作切除術和鉑類化療後的輔助治療,用於 II 至 IIIA 期非小細胞肺癌患者。這是第一個也是唯一一個可用於 NSCLC 輔助治療的癌症免疫療藥物,是腫瘤藥物發展史的重要里程碑!
該申請批准是根據IMpower010(NCT02486718) Ⅲ 期試驗資料,共有 1280 名患者納入了該實驗並接受了順鉑+培美曲塞/吉西他濱/多西他賽/長春瑞濱治療1至4個週期,然後其中1005名患者以1:1的比例隨機接受每21天1200mg的T藥或BSC。
該試驗的主要終點是研究者評估的 DFS,該 DFS 進行了分層測試:
(1)II 至 IIIA 期疾病且 PD-L1 表達為 1% 或更高的患者;
(2)II 至 IIIA 期疾病的所有隨機患者;
(3)意圖IB 至 IIIA 期疾病的治療 (ITT) 人群。
次要終點包括:ITT 人群的總生存期 (OS)、PD-L1 表達≥50% 的 II 至 IIIA 期疾病患者的 DFS,以及所有 3 個人群的 3 年和 5 年 DFS .
根據在2021年ASCO年會上更新的最新資料顯示,中位隨訪時間為32.2個月(範圍,0.57-5),在PD-L1 TC≥1%的Ⅱ~ⅢA期患者中,雖然T藥組尚未達到中位無病生存期(DFS),但是T藥相比對照組有顯示的DFS獲益,對照組中位DFS為35.3個月(HR=0.66,95%CI: 0.50~0.88,P=0.004),36個月DFS率60.0% vs 48.2%。
研究組和對照組中所有隨機化任何PD-L1表達的II和IIIA期人群的中位無病生存期(DFS)為42.3個月(95% CI,36.0–NE)和35.3個月(95% CI,30.4-46.4 HR,0.79;95% CI,0.64-0.96;P =0.02);
在 ITT 人群中,研究組 (n = 507) 和對照組 (n = 498) 的中位 DFS 分別不可評估 (95% CI, 36.1–NE) 和 37.2 個月 (95% CI, 31.6–NE) (HR,0.81;95% CI,0.67-0.99;P =0.04)。
從實驗中的II-IIIA期NSCLC患者資料結果來看,與最佳支援治療(BSC)相比,T藥的加入與復發或死亡風險的小幅度降低相關,中位隨訪32.2個月後的HR為0.79 (P=0.02);在ITT人群分析中,T藥降低復發或死亡風險的幅度具有臨界意義,中位隨訪32.2個月後的風險比為0.81(P=0.04)。
NMPA批准 CDK4/6 抑制劑國內臨床試驗,用於晚期實體瘤
2021年10 月 19 日,NMPA批准了甘李藥業自主研發的 CDK4/6 抑制劑 GLR2007 在國內的一項 Ib/II 期臨床,用於治療晚期實體瘤。
早在 2020 年 7 月,這款新藥已經在美國率先啟動 I 期臨床,並在 2020 年 9 月獲得 FDA 孤兒藥資格認定,2021 年 1 月獲得 FDA 快速通道審評資格認定,用於治療膠質母細胞瘤(GBM)。2021 年 4 月,該藥獲得 EMA 孤兒藥資格認定,用於膠質瘤(Glioma)的治療。GLR2007 是一種新型 CDK4/6 抑制劑,具有潛在的高血腦屏障滲透性特徵,有望為膠質瘤患者提供新的療法。
NMPA批准君實 PD-1聯合 PCSK9 單抗,治療晚期腫瘤
2021年10 月 20 日,CDE 官網顯示,君實生物的 PCSK9 單抗昂戈瑞西單抗(研發代號:JS002)獲批臨床,聯合 PD-1 特瑞普利單抗治療晚期實體瘤。這是國內首個獲批臨床的 PCSK9 + PD-1 聯合療法。
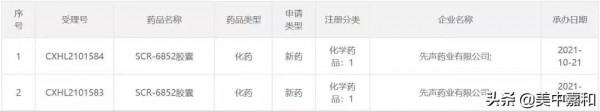
NMPA受理SCR-6852膠囊臨床試驗申請,用於治療乳腺癌
2021年10月21日,中國國家藥品監督管理局藥品審評中心(CDE)顯示,已經先聲藥業的d自研創新藥SCR-6852膠囊(SIM0270)的臨床試驗申請(IND)已獲得受理,擬用於治療ER+/HER2-型區域性晚期或轉移性乳腺癌。
歐洲批准了納武利尤單抗獲用於胃腺癌、GEJ 或食管腺癌
2021 年 10 月 22 日,歐盟委員會已批准納武單抗 (Opdivo) 加氟嘧啶和鉑類化療用於 HER2 陰性晚期或轉移性胃、胃食管結合部 (GEJ) 或食管腺癌的成人患者的一線治療。這些患者的腫瘤具有 PD-L1 聯合正分 (CPS) 為 5 或更高。
監管決定基於第 3 期 CheckMate-649 試驗 (NCT02872116) 的資料,在該試驗中,將納武單抗加入化療後,總生存期 (OS) 和無進展生存期 (PFS) 的改善具有統計學意義和臨床意義在這個患者群體中單獨使用化療。
在 19.4 個月的隨訪中,納武利尤單抗聯合化療在 PD-L1 CPS 為 5 或更高的患者中的中生存期(OS)為 14.4 個月(95% CI,13.1-16.3)與 11.1 個月(95% CI, 10.0-12.1) 。研究組的中位 PFS 為 8.31 個月(95% CI,7.03-9.26),而對照組為 6.05 個月(95% CI,5.55-6.90)(HR,0.68;95% CI,0.59-0.79)。
作者|翳安醫學部
來源|找藥寶典