摘要 2015年諾貝爾化學獎授予了Tomas Lindahl、Paul Modrich和Aziz Sancar三位科學家,以表彰他們在“繪製細胞修 復損傷DNA和捍衛遺傳資訊(完整性)的機制研究”方面所做出的傑出貢獻。簡要介紹了三位獲獎者的研究工作和成就, 以及DNA損傷修復與人類疾病(尤其是癌症)的發生、發展、診斷、治療及預防的相關性。
從低等生物到高等動物乃至人類,其基因 組DNA無一例外地儲存著生物體賴以生存和繁 衍的遺傳資訊,因此,維持基因組的穩定性是 生命延續的根本保障。不幸的是,基因組DNA 時時刻刻受到各種內外因子的攻擊而造成多種損 傷。外在因子包括太陽光中的紫外線和空氣中的 天然放射性氣體氡;內在因子有相當大的部分來 自細胞內代謝過程中產生的自由基。這些DNA 損傷事件可以達到每天每個細胞6萬多次。以我 們人體為例,平均每個人的細胞數為1013 ~1014 個,我們機體每天經受著天文數字般(達到每天 6×(1019 ~1020 )個)的DNA損傷事件!還有,細胞 分裂過程中基因組DNA的複製並不是無誤的, 由此也會引入DNA損傷。幸運的是,我們生物 體進化出應對各種DNA損傷形式的“專業修理 工程隊”:以未被損傷的同源DNA為模板,精 確完成修復;或者不計後果地快速完成修復,從 而在基因組DNA引入改變。這些改變的積累最 終破壞了基因組的穩定性,導致各種各樣的疾 病,包括癌症、退行性神經病變和早衰等。另一 方面,癌症治療中的許多化療藥物和放射治療 都是透過對細胞基因組DNA造成不可修復的損傷,從而誘導細胞凋亡。由此看來,對DNA損 傷的各種“專業修理工程隊”的組成和工作機制 的認知,不僅僅有助於闡明疾病發生和發展的分 子機制,也為疾病(尤其是癌症)的治療提供生物 學基礎。因此,在過去的幾十年,DNA修復研 究一直是生命醫學領域的核心熱點。 2015年10月7日,瑞典皇家科學院宣佈將2015 年諾貝爾化學獎授予瑞典的Tomas Lindahl、美國的 Paul Modrich和土耳其的Aziz Sancar三位先驅科學家 (圖1),以表彰他們在“繪製細胞修復損傷DNA和 捍衛遺傳資訊(完整性)的機制研究”方面所做出的 傑出貢獻。三位科學家分別是鹼基切除修復、鹼 基錯配修復和核苷酸切除修復“工程隊”的“伯 樂”。無獨有偶,2015年9月具有“諾貝爾獎風向 標”稱號的拉斯克基礎醫學研究獎授予美國新澤 西州羅格斯大學Evelyn M. Witkin和哈佛大學醫學 院布萊根婦女醫院Stephen J. Elledge,以獎勵他們 在“DNA 損傷應答保護所有生物基因組穩定性” 的開創性研究。DNA“修理工”相關研究在同一 年度同時被諾貝爾獎和拉斯克獎所青睞是前所未 有的,在可見的未來也很可能不會再有,因此, 將2015年稱作“DNA修復之年”是再恰當不過的!
1 鹼基切除修復
Tomas Lindahl於1938年出生在瑞典斯德哥 爾摩,1967年在瑞典卡羅琳斯卡醫學院取得醫學 博士學位,隨後在美國普林斯頓大學及洛克菲勒 大學進行博士後研究。1978—1982年,他任職 於哥德堡大學(醫學與生理化學教授),並於1981 年加入英國帝國癌症研究基金會。1986年至今, Lindahl任劍橋大學克萊爾實驗室主任、弗朗西 斯克裡克研究所名譽負責人。 Lindahl的主要貢獻是揭示DNA分子的不穩 定性和鹼基切除修復的分子機理。自1953年科 學家發現DNA雙螺旋結構以來,科學界普遍相 信作為生命基礎的DNA分子是非常穩定的。但 是,在20世紀70年代早期,Lindahl透過實驗證 明:即便沒有外界物理因素的攻擊,DNA的化 學穩定性也是有限的[1-2] 。20世紀70年代到80年 代間,Lindahl描述和量化了自發的內源性DNA 損傷,包括脫嘌呤水解、胞嘧啶殘基脫氨基、 鳥嘌呤和嘧啶殘基的氧化以及腺嘌呤殘基甲基 化生成3-甲基腺嘌呤等。人的基因組每天所遭 受的潛在損傷和細胞毒性損傷的數量達10 000 次。這些結果說明生物體內必然存在DNA修復 酶和修復機制來抵消內源性DNA損傷[3] 。DNA由 脫氧核苷酸的四種鹼基腺嘌呤(A)、鳥嘌呤(G)、 胞嘧啶(C)和胸腺嘧啶(T)組成,鹼基互補配對原 則(A=T,C≡G)可以確保遺傳資訊的傳遞和復 制。DNA的胞嘧啶殘基很容易丟失一個氨基變成脲嘧啶(U),這樣受損的胞嘧啶殘基往往與腺 嘌呤配對,而不是正確地與鳥嘌呤配對。如果允 許這樣的缺陷繼續存在,下一次DNA複製時就 會發生永久性的突變。Lindahl意識到細胞內必 然存在某種防護機制,於是開始利用細菌DNA 來尋找修復酶,終於在1974從大腸桿菌中分離了 第一個能夠識別受損鹼基的DNA N-糖苷酶(DNA N-glycosidase) [4] 。該酶作用於糖苷鍵並將脲嘧啶 切除,產生含有脫嘧啶位點的DNA鏈,然後其他 幾個酶將DNA鏈中這個核苷酸剩餘的部分移除, 在DNA聚合酶作用下根據模板鳥嘌呤的資訊重新 修復為胞嘧啶,最後透過DNA連線酶將切口封閉 (圖2)。這一多種酶參與的DNA修復過程後來被 稱為鹼基切除修復。 在1994和1996年Lindahl分別從大腸桿菌和 人類細胞中純化出修復蛋白,體外重建鹼基切除 修復通路,證明了人細胞也存在鹼基切除修復機 制[5-6] 。至今他已經發現超過100種不同的DNA氧 化損傷,這些損傷大部分是由鹼基切除修復來完 成的。隨後,Lindahl在哺乳動物細胞中發現多種 不同型別的DNA連線酶,並對DNA連線酶I、III 和IV的遺傳和生化特性開展了一系列開創性的研 究工作。他還發現了哺乳動物細胞中DNA特異的 核酸外切酶DNase III (TREX1) 和 IV (FEN1) [3] 。 值得一提的是,TREX1基因的缺失是系統性紅斑 狼瘡及其相關自身免疫性疾病的一種病因。 Lindahl的研究工作首次闡明瞭一條需要多
個酶參與的DNA 修復通路。由於鹼基損傷事件 在生物機體內頻繁發生,其詮釋的生理和病理機 理具有里程碑意義,為DNA修復機制的研究開 啟了大門。
2 鹼基錯配修復
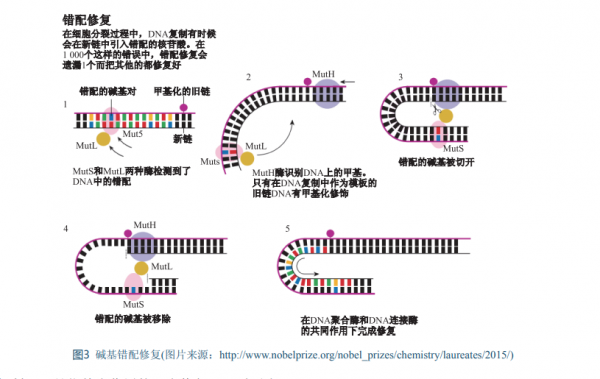
Paul Modrich於1946年出生在美國,1973年在 美國斯坦福大學取得醫學博士學位,之後擔任美 國杜克大學醫學中心生物化學冠名教授。1994年至 今Modrich任霍華德•休斯醫學研究所的研究員。 Modrich的主要貢獻是揭示DNA鹼基錯配 修復的分子機理。正如前面所提到的,基因組 DNA在複製過程中也會出現錯配,從而導致 DNA雙螺旋結構的扭曲。據估計,在體外實 驗中這種錯配的機率大約是5×10-5 ,而人的生 殖細胞的錯配率是1×10-8 ,這應該歸功於機體 的DNA錯配修復機制[7] 。1983年,Modrich和 Meselson發現細菌中Dam甲基化酶給DNA加上甲 基基團,有利於某個特定的限制性內切酶在正確 的位置切斷DNA鏈,以降低錯配機率[8] 。後來, Modrich建立了基於無細胞的大腸桿菌抽提物的 錯配修復系統[9] ,並利用該系統鑑定了一個又一 個參與錯配修復的基因及其編碼的蛋白。 1989年,Modrich終於在體外重建了大腸桿菌的DNA錯配修復過程[10] 。這項工作闡述了 DNA聚合酶III、核酸外切酶I和DNA連線酶對於 錯配修復的必要性,而進一步的研究說明了這些 酶和MutH、MutL、MutS、UvrD及單鏈結合蛋 白在體內進行鹼基錯配修復的分子機理(圖3)。 直到2004年,Modrich在體外重建了人的錯配修 復體系[11] ,從而為進一步揭示哺乳動物細胞錯配 修復機制奠定了基礎。
3 核苷酸切除修復
Aziz Sancar於1946年出生於土耳其的薩烏 爾,但是他絕大部分的學術生涯是在美國度過 的。1977年Sancar於美國德州大學達拉斯分校取 得博士學位,目前為美國北卡羅來納大學教堂山 分校生物化學與生物物理教授。 Sancar的主要貢獻在於揭示了核苷酸切除修 復的分子機制。以下的現象激發了他的研究興 趣:細菌在致命的紫外線(UV)照射之後,如果 再用可見藍光照射,它們突然就能死裡逃生。這 首次表明了DNA修復酶的存在,該酶(光修復酶) 能修復紫外輻射誘導的DNA損傷。 1976年,Sancar作為博士生在Claud Rupert 教授的實驗室成功地克隆出光修復酶基因。當 時,人們已經知道細菌有兩套修復紫外線損傷的
機制:一是依賴光作用的“光修復”,需要光 修復酶;另一個則是不依賴於光的暗修復。1981 年,Sancar利用功能互補克隆技術鑑定了細菌暗修復的三個基因,即uvrA、uvrB與uvrC[12-14] 。 1983年,他從細菌中純化得到UvrA、UvrB和 UvrC蛋白[15] ,而且在體外實驗中發現,這三種蛋 白的協同作用可以識別紫外輻射DNA損傷,並在 DNA受損部位的兩側鏈上發生剪下,切除包括損傷位點在內的一段12~13個鹼基對的片段(圖4)。 後來,Sancar發現UvrD(DNA解旋酶II)和DNA聚 合酶I可以提高反應速率,它們分別負責催化受損 鏈的移除和新鏈的合成,最後DNA連線酶催化合成新的磷酸二酯鍵,將新合成DNA和原來的DNA 鏈連線起來[16] 。至此,Sancar成功繪製了細菌中的核苷酸切除通路。1995年,他證明人的細胞中 也存在類似的修復系統,只是人的修復系統更為 複雜,參與的蛋白因子達到15個之多[17] 。 此外,1984—1989年Sancar發表了一系列的 文章來闡述光修復酶的作用機制,證明光修復酶 可將吸收光子的能量轉化成化學能產生區域性自由 基,從而起始胸腺嘧啶二聚體的降解。Sancar在 光修復中做了非常出色的工作。
三位獲獎人在DNA修復領域做出了原創而經 典的工作,開創了DNA修復的新紀元。他們的共同的特點在於體內發現,並利用體外純化核心修復 酶重建系統來驗證這一從低等到高等生物中普遍存在且高度保守的基因組穩定性維持的衛士。
4 諾貝爾獎“風向標”
讓人興奮的是,2015年9月生理學和醫學 領域的另一項大獎——拉斯克基礎醫學研究獎 授予美國新澤西州羅格斯大學Evelyn M. Witkin 和哈佛大學醫學院布萊根婦女醫院Stephen J. Elledge,以獎勵他們關於“DNA 損傷應答保護 所有生物基因組穩定性機制”的發現。這是美國 最具聲望的生物醫學獎項,迄今為止共有超過 300人次獲得拉斯克獎,而其中有81位後來獲得 了諾貝爾獎,所以該獎項也被看作諾貝爾獎的 “風向標”。讓人自豪的是憑藉青蒿素的發現 獲得2011年拉斯克臨床醫學獎的中國科學家屠呦 呦,也於2015年獲得了諾貝爾生理學或醫學獎。 Witkin最初以細菌DNA修復為切入點,對 紫外線如何引發細菌DNA突變的機制以及細菌
內特殊基因如何響應脅迫機制進行了研究。這 為後來DNA損傷應急修復機制(SOS)提供了理論 基礎。1987年Elledge在實驗中意外發現當DNA 受損或複製叉阻滯時,酵母體核心苷酸還原酶 的mRNA含量會急劇上升。這個偶然發現讓他對 DNA修復的分子機制產生了極大的興趣並投入 其中。最為突出的貢獻是他發現真核生物中當損傷造成DNA單鏈斷裂或雙鏈斷裂時,以ATR和 ATM激酶為核心的訊號傳導途徑[18] 。
5 DNA修復與人類健康
DNA修復缺陷與許多血液、免疫、神經等 系統的病變密切相關,是癌症發生、發展的根 本原因。人體核苷酸切除修復缺陷時會表現出 各種疾病,最常見的是著色性幹皮病(xeroderma pigmentosum,XP),典型特點是患者的面板和 眼睛對太陽光特別是紫外輻射十分敏感,病因是 細胞對嘧啶二聚體和烷基化的清除能力降低,易 罹患面板癌。錯配修復基因存在缺陷就可能造成 癌症,如遺傳性非多發性息肉結腸癌(hereditary nonpolyposis colorectal cancer,HNPCC),就與 DNA 的錯配修復基因突變密切相關,特別是 hMSH2 和 hMLH1 基因的突變。遺傳性乳腺癌 基因BRCA1/2參與修復受損的DNA以抑制癌症的發生,而當發生變異時,細胞修復DNA損傷 的能力大為降低,導致攜帶該類基因變異的健康 人群更易罹患乳腺癌和卵巢癌。共濟失調性毛細 血管擴張症(ataxia telangiectasia,A-T)是一種人 類常染色體隱性遺傳性疾病,其致病基因ATM 是參與調控DNA損傷應答的核心激酶,A-T病人 的典型特徵是神經退行性病變和對DNA損傷事 件如離子輻射異常敏感。 最新發布的《2015中國腫瘤登記年報》顯 示,2011年我國新增癌症病例約337萬例,比 2010年增加28萬例——這相當於每分鐘就有6個 人罹患癌症。目前,透過對細胞基因組DNA造 成不可修復的損傷來殺死腫瘤細胞是臨床放化療 的作用機制。然而其選擇性不強,在殺死癌細胞 的同時也會損傷人體正常的細胞,從而出現一系 列的不良反應。如何將輻射劑量或化療藥物靶向 性投向癌灶或特異性增加腫瘤細胞對輻射或化療 藥物的敏感性,亟待DNA修復的基礎研究人員 和放射腫瘤醫生的攜手攻關。 近年來,合成致死概念的臨床轉化為癌症 的靶向放化療提供了希望。合成致死指兩種功能 缺陷同時發生時對細胞是致死性的,但是其中 任何一種缺陷單獨存在都不影響細胞的生存。 聚ADP核糖聚合酶(PARP)抑制劑抑制單鏈DNA 斷裂(SSB)的修復,未修復的SSB的積累會形成致死性的DNA雙鏈斷裂(DSBs) [19] ,而精確的 DSB修復是由同源重組(HR)所介導的。因此, HR修復缺陷的細胞對PARP抑制劑非常敏感。 Olaparib(奧拉帕尼)是世界上首個批准上市的可 遺傳癌症突變PARP抑制劑,可治療HR調控關鍵 基因BRCA1/2突變引起的乳腺癌。由於DNA二 代測序成本的大幅下降,在各種遺傳性和非遺傳 性的腫瘤基因組中鑑定HR修復基因的缺陷,探 索與各種PARP抑制劑及輻射的聯合治療,這將 成為非常有希望的癌症治療方案。同時,利用化學小分子庫篩選與PARP抑制劑具有協同致死效 應的新化合物,有望找到新的抗癌先導化合物。 任何事物都有其兩面性。我們需要DNA修 復來維護基因組的穩定性,防止癌症的發生、發 展。但是與此同時,我們不要晚期癌細胞的增強 版DNA修復能力,因為這種超強的修復能力賦 予這些癌細胞對放化療的耐受性。因此,有效抑 制癌細胞的修復活性也是癌症治療的策略之一。
6 展望
2015年諾貝爾獎和拉斯克獎同時鍾情於基因 組DNA的“修理工”,這是DNA修復領域的大喜 事,值得慶賀。雖然我們知道了參與DNA修復的 眾多因子及其功能和主要的通路,但是,這些因子 或通路如何組成網路調控DNA修復過程?如何與 其他細胞活動(如RNA加工、三大物質代謝)協調完成對損傷DNA的修復?如何將DNA修復的基礎研究成果轉化成DNA修復相關疾病的診斷、治療和 預防的利具……這些挑戰亟待更多人的參與研究。