- 【矽的物理性質】
- 矽,元素符號Si,原子序數14,原子量28.086,位於第三週期第IVA族,共價半徑117皮米,離子半徑42皮米,第一電離能786.1kJ/mol,電負性1.8,密度2.33g/cm3,熔點1410℃,沸點2355℃,硬度7。元素矽有無定形矽和晶體矽兩種同素異形體。無定形矽為黑色;晶體矽呈鋼灰色,有明顯的金屬光澤、晶格和金剛石相同,硬而脆,能導電,但導電率不如金屬且隨溫度的升高而增加,屬半導體。在熱處理溫度大於750℃時,矽材料由脆性材料轉變為塑性材料,在外加應力下,產生滑移位錯,形成塑性變形。矽材料還具有一些特殊的物理性質,如矽材料熔化時體積縮小,固化時體積增大。
- 作為半導體材料,矽具有典型的半導體材料的電學性質。
- (1)阻率特性 矽材料的電阻率在10-5~1010Ω•cm之間,介於導體和絕緣體之間,高純未摻雜的無缺陷的晶體矽材料稱為本徵半導體,電阻率在10Ω•cm以上。
- (2)PN接面特性 N型矽材料和P型矽材料相連,組成PN接面,這是所有矽半導體器件的基本結構,也是太陽電池的基本結構,具有單向導電性等性質。
- (3)光電特性 與其他半導體材料一樣,矽材料組成的PN接面在光作用下能產生電流,如太陽電池。但是矽材料是間接帶隙材料,效率較低,如何提高矽材料的發電效率正是目前人們所追求的目標。
- 同位素
- 矽(原子質量單位: 28.0855)共有23種同位素,其中有3種天然的穩定同位素Si(92.2%)、Si(4.7%)和Si(3.1%),還有質量數為25、26、27、31和32的人工放射性同位素。
【矽的化學性質】
- 低溫時單質矽不活潑,不與空氣、水和酸反應。室溫下表面被氧化形成1000皮米二氧化矽保護膜。高溫時能跟所有鹵素反應,生成四鹵化矽,跟氧氣在700℃以上時燃燒生成二氧化矽。跟氯化氫氣在500℃時反應,生成三氯氫矽SiHCl3和氫氣。高溫下能跟某些金屬(鎂、鈣、鐵、鉑等)反應,生成矽化物。赤熱時跟水蒸氣反應生成二氧化矽和氫氣。跟強鹼溶液反應生成矽酸鹽放出氫氣。跟氫氟酸反應生成四氟化矽。
【矽的分類】
- 按純度可分為:工業矽、太陽能級矽、電子級矽。
- 按摻雜型別分為:本徵矽、P型矽、N型矽。
- 按晶體型別分為:單晶矽、多晶矽、非晶矽。
【晶態矽與非晶態矽的結構】
- 矽按照晶體形態分為晶態和非晶態兩種,晶態矽又分為單晶矽和多晶矽,不同形態的矽材料具備不同的結構。
- (1)單晶矽的結構
- 單晶矽即矽的單晶體,具有基本完整的點陣結構晶體,不同的方向具有不同的性質,是一種良好的半導體材料。用於製造半導體器件,太陽能電池等。是採用高純度的多晶矽在單晶爐內拉制而成的。熔融的單晶矽在凝固時矽原子以金剛石晶格排列成許多晶核,如果這些晶核長成晶面取向相同的晶粒,則這些晶粒平行結合起來便結晶成單晶矽。
- 單晶矽具有準金屬的物理性質,有較弱的導電性,其電導率隨溫度的升高而增加,有顯著的半導電性。單晶矽具有金剛石晶格,晶體硬而脆,具有金屬光澤,但導電率不及金屬,隨著溫度增加,具有半導體性質。如圖7-6所示
- (2)多晶矽的結構
- 多晶矽,是單質矽的一種形態。熔融的單質矽在過冷條件下凝固時,矽原子以金剛石 晶格形態排列成許多晶核,如這些晶核長成晶面取向不同的晶粒,則這些晶粒結合起來,就結晶成多晶矽。
- 多晶矽具有灰色金屬光澤,熔點1410℃。沸點2355℃。溶於氫氟酸和硝酸的混酸中,不溶於水、硝酸和鹽酸。硬度介於鍺和石英之間,室溫下質脆,切割時易碎裂。加熱至800℃以上即有延性,1300℃時顯出明顯變形。常溫下不活潑,高溫下與氧、氮、硫等反應。在高溫熔融狀態下,具有較大的化學活潑性,能與幾乎任何材料作用。具有半導體性質,是極為重要的優良半導體材料,但微量的雜質即可大大影響其導電性。
- (3)非晶矽的結構
- 非晶矽又稱無定形矽。單質矽的一種形態。棕黑色或灰黑色的微晶體,不具有完整的金剛石晶胞,純度不高。熔點、密度和硬度也明顯低於晶體矽。
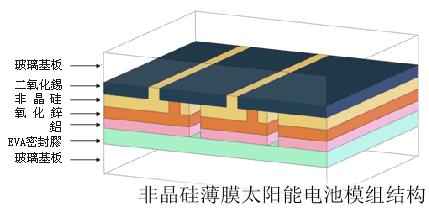
- 非晶矽的用途很多,可以製成非晶矽場效應電晶體;用於液晶顯示器件、整合式a—Si倒相器、整合式圖象感測器、以及雙穩態多諧振盪器等器件中作為非線性器件;利用非晶矽膜可以製成各種光敏、位敏、力敏、熱敏等感測器;利用非晶矽膜製做靜電覆印感光膜,不僅影印速率會大大提高,而且圖象清晰,使用壽命長;等等。目前非晶矽的應用正在日新月異地發展著,可以相信,在不久的將來,還會有更多的新器件產生。